I. ÁTOMOS Y MOLÉCULAS EN EL UNIVERSO. LA TABLA PERIÓDICA DE LOS ELEMENTOs.
A
STRÓNOMOS y físicos han postulado como origen del Universo una gran explosión, que a partir de un gas denso formó las innumerables galaxias que ahora pueblan el Universo. Una de dichas galaxias es la Vía Láctea, formada por más de 100 mil millones de estrellas, entre las que se encuentra nuestro Sol.
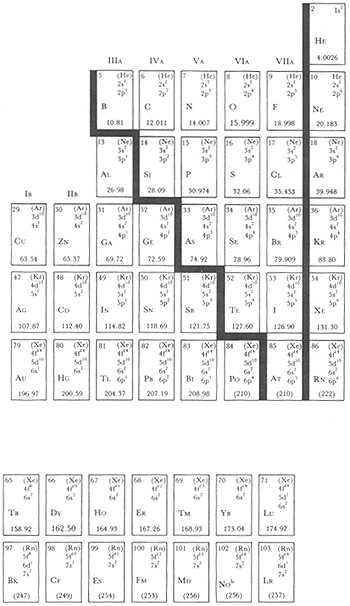
Cuando la temperatura del Universo era de alrededor de mil millones de grados, se comenzaron a formar los núcleos de los elementos. Primero se formaron los más simples, el hidrógeno (H) y el helio (He); posteriormente, en el interior de las estrellas se fueron formando los núcleos de otros elementos, hasta llegar a un número cercano a 100. Los químicos los han ido descubriendo poco a poco y han encontrado que se pueden clasificar de acuerdo con sus propiedades físicas y químicas en lo que se ha nombrado la tabla periódica de los elementos (Figura 1).
Más tarde, el Universo se fue enfriando paulatinamente hasta llegar a una temperatura de 3°K, que es la que tienen en la actualidad los espacios interestelares.
Los primeros elementos formados, que son también los más ligeros, el hidrógeno (H) y el helio (He), siguen siendo los principales constituyentes del Universo. El hidrógeno se encuentra en una proporción superior a 90% y el helio en alrededor de 8%. Estos elementos son más abundantes en el Sol y en las otras estrellas.
El hidrógeno, el elemento más sencillo y más abundante en el Universo, es un gas más ligero que el aire, por lo que, al llenar un globo con él, habrá necesidad de sujetarlo, o de lo contrario, se elevará por los aires. Esta propiedad fue aprovechada por el hombre para viajar por la atmósfera. Desde finales del siglo XVIII se construyeron máquinas voladoras para transportar hombres y equipo. Estas naves, llamadas dirigibles, eran peligrosas por el carácter inflamable del hidrógeno con el que se habían llenado.
El átomo de hidrógeno (H), como hemos dicho, el elemento más sencillo del Universo, está formado por un núcleo, llamado protón, que posee una carga positiva, la cual se encuentra neutralizada por un electrón (carga negativa).
El hidrógeno se combina con otros elementos formando moléculas. Cuando se mezcla con oxígeno en un soplete y se le prende fuego, arde produciendo flama de color azul pálido, liberando tal cantidad de calor que funde al hierro con facilidad, por lo que el soplete oxhídrico se usa para cortar láminas de acero. En esta reacción el oxígeno y el hidrógeno se combinan produciendo agua, que se escapa en forma de vapor.
Cuando en un recipiente cerrado se pone una unidad de peso de hidrógeno por 8 de oxígeno y se produce en su interior una chispa eléctrica, se provoca una explosión con formación de agua (Figura 2) sin gases sobrantes, pero si la cantidad de uno de los gases excede a las proporciones antes dichas, quedará el exceso sin reaccionar. A esto se le llama Ley de las proporciones constantes e indica que dos átomos de hidrógeno, cada uno de peso atómico 1, reaccionan con un átomo de oxígeno, con peso atómico de 16, produciendo una molécula de agua, con peso molecular de 18.
PROPIEDADES DEL AGUA
El agua, producto formado en la combustión del hidrógeno, es la molécula más abundante en la Tierra, donde se le encuentra en sus tres estados físicos: como líquido, cubriendo las 3/4 partes de la superficie del planeta, constituyendo mares, ríos y lagos; como vapor, en grandes cantidades en la atmósfera, de donde se precipita como lluvia o nieve, y en su estado sólido (hielo), formando depósitos sobre las altas montañas y cubriendo las regiones polares y en este caso en tal cantidad, que si este hielo se fundiera, el nivel del océano subiría de tal manera que inundaría la mayor parte de las ciudades costeras y gran parte de las tierras bajas, incluyendo países enteros como Holanda, que quedaría totalmente bajo las aguas.
Esta molécula tan singular y abundante es la base de la vida; constituye más de la mitad del peso de los seres vivos. En los organismos marinos se le encuentra en una proporción de más de 90% en peso.
El agua, en estado puro, es un líquido incoloro, inodoro e insípido. Las propiedades físicas de tan importante sustancia a menudo se toman como tipo: su punto de fusión es de 0° su punto de ebullición a nivel del mar es de 100° la mayor densidad del agua se alcanza a 4°, siendo de 1 g/ml, es decir que cada mililitro pesará un gramo y por lo tanto un litro pesará un kilogramo.
Su calor específico es de 1.00 caloría por grado, por gramo, o lo que es lo mismo, un gramo de agua elevará su temperatura en un grado centígrado cuando se le suministra una cantidad de energía en forma de calor equivalente a una caloría. Por ejemplo, para elevar la temperatura de un litro de agua de 20 a 21° se necesitará suministrar una cantidad de calor equivalente a 1 000 calorías.
Como se ve, las propiedades físicas del agua son casi siempre la unidad. Esto no es accidental, pues siendo el agua el líquido más abundante y accesible y teniendo propiedades tan singulares, no es de extrañar que se le tome como referencia para medir las de otras sustancias, sobre todo si son líquidas.
El hecho de que el hielo sea menos denso que el agua líquida tiene gran importancia en el mantenimiento de la vida en las regiones frías del planeta: cuando un lago se congela, sólo lo hace en su superficie, ya que el hielo, por ser menos denso que el agua, flota sobre ella y, por ser mal conductor del calor, aisla las capas más profundas impidiendo su congelación, con lo que se logra mantener las condiciones apropiadas para la conservación de la vida. Este hecho afortunado para la vida en el planeta tiene, sin embargo, consecuencias negativas para lo que llamamos progreso de nuestra civilización, ya que los grandes témpanos de hielo (icebergs) son un peligro para la navegación en aguas frías y han destruido muchas embarcaciones.
Más aún, el agua de las tuberías, que la conducen a nuestras ciudades, se expande al congelarse, rompiendo las tuberías; lo mismo sucede con muchos recipientes rígidos que se rompen cuando se congela el agua que contienen.
LA ELECTRÓLISIS EN LA OBTECIÓN DE METALES
Aluminio
El aluminio es el tercer elemento más abundante en la corteza terrestre. Se le encuentra formando parte de minerales tan comunes como el granito y la mica, las arcillas con las que se hacen los ladrillos, y el caolín con el que se fabrica la porcelana y se recubren los utensilios de cocina para proteger al hierro de la oxidación (peltre).
La bauxita es un óxido de aluminio muy abundante. De él se obtiene el aluminio metálico mediante un proceso electrolítico muy ingenioso, descubierto simultáneamente en los Estados Unidos por Charles M. Hall, joven de 22 años, y en Francia por un joven, también de 22 años, llamado P. L. T. Heroult.
El procedimiento descubierto por ambos jóvenes nacidos en 1863 fue idéntico; ambos se hicieron ricos, disfrutando de ello hasta el fin de sus vidas, que curiosamente aconteció, también en ambos casos, en 1914.
Para obtener aluminio a partir de bauxita, ésta es previamente purificada, y disuelta posteriormente en un baño de criolita fundida. La solución caliente de bauxita (óxido de aluminio o A12 O3) en criolita es colocada en una tina de carbón, se insertan en ellas barras de grafito y se hace pasar corriente eléctrica a través del mineral fundido. Como resultado de este proceso, el óxido se descompone y el aluminio se deposita en el fondo de la tina, de donde es posible recuperarlo.
Con este descubrimiento, el aluminio se abarató, y como llegó a ser tan común y sus usos tan variados, hoy en día se le puede ver en todas las cocinas y formando parte de las fachadas de la mayoría de los edificios.
Helio
El helio, segundo elemento más abundante en el Universo y en el Sol, es también un gas ligero que, a diferencia del hidrógeno, es inerte, es decir, no se combina con otros elementos. Como no es inflamable, se usa con plena confianza en el llenado de dirigibles. El helio es tan poco reactivo, que no se combina ni consigo mismo, por lo que se encuentra como átomo solitario He, en vez de encontrarse en forma de moléculas diatómicas como el oxígeno (O2) o el hidrógeno (H2).
El helio, segundo elemento más abundante en el Universo y en el Sol, es también un gas ligero que, a diferencia del hidrógeno, es inerte, es decir, no se combina con otros elementos. Como no es inflamable, se usa con plena confianza en el llenado de dirigibles. El helio es tan poco reactivo, que no se combina ni consigo mismo, por lo que se encuentra como átomo solitario He, en vez de encontrarse en forma de moléculas diatómicas como el oxígeno (O2) o el hidrógeno (H2).
El helio, primero de los gases nobles, tiene en su núcleo dos protones y su única capa electrónica se encuentra saturada con dos electrones, razón por la que es un elemento inerte.

Los demás elementos que existen en el Universo van siendo cada vez más pesados y se encuentran ordenados en la tabla periódica (Figura 1).
Los únicos elementos que no reaccionan y permanecen siempre como átomos solitarios son los gases nobles. Estos elementos se les encuentra, encabezados por el helio, en la última columna de la tabla periódica. Como ya vimos en el caso del helio, son inertes por tener saturada su última capa electrónica; por lo tanto, ni reciben ni dan ni comparten electrones con otros átomos.
MI OPINIÓN.
La importancia de este capítulo para mi es que se menciona información acerca del origen del universo y más importante aun él porque existen los elementos como el hidrogeno que es elemento más abundante en el universo y como este al combinarse con el oxigeno forma el agua compuesto crucial para la vida en el planeta otra cosa importante que se menciona es como la atmosfera primitiva del planeta al posesr distintos tipos de gases logro sustentarse la vida y como desde ese momento se desencadeno un largo proceso que continua asta nuestros días.
II. EL ÁTOMO DE CARBONO, LOS HIDROCARBUROS, OTRAS MOLÉCULAS ORGÁNICAS, SU POSIBLE EXISTENCIA EN LA TIERRA PRIMITIVA
Y EN OTROS CUERPOS CELESTES
L
A TEORÍA de la gran explosión como origen del Universo concibe la formación del átomo de carbono (peso atómico = 12) en el interior de las estrellas mediante la colisión de tres átomos de helio (peso atómico = 4).
La generación del carbono y de los átomos más pesados se dio en el interior de las estrellas antes de la formación de nuestro Sistema Solar, cuyo nacimiento, a partir de materiales cósmicos, polvo y gas provenientes de los restos de estrellas que explotaron, se remonta a un pasado inimaginable: algo así como 4 600 millones de años.
Cuando la tenue nube de polvo y gas fue comprimida por la onda de choque producida por la explosión de una estrella de las llamadas supernovas, se formó la nebulosa en cuyo centro la materia se concentró y calentó hasta producir nuestro Sol.
Rodeando al Sol, la materia fue siendo cada vez mas fría y sus elementos constitutivos más ligeros. Con este material se formaron los planetas y sus lunas.
La diferente composición química del cuerpo de los planetas y de su atmósfera se debe en parte a que se formaron en regiones de la nebulosa con distintas temperaturas, por lo que los planetas interiores, Mercurio, Venus, Tierra y Marte, son rocosos, con gran proporción de metales, óxidos y silicatos. En cambio, los planetas exteriores contienen más gases. Así, los planetas interiores han perdido alrededor de 98% de su peso original por haber estado formados de material volátil como hidrógeno y helio, mientras que los planetas lejanos conservan enormes cantidades de hidrógeno y helio.
La Tierra, el tercer planeta del Sistema Solar, tuvo la fortuna de no ser tan caliente como Mercurio y Venus, ni tan frío como los planetas más alejados del Sol. Contiene agua en abundancia y carbono en cantidades también relativamente abundantes, además del resto de los elementos estables, es decir todos los elementos de la tabla periódica hasta el número 92, metal conocido con el nombre de uranio (Figura 1).
Los elementos del 93 al 109, llamados transuránicos, han sido preparados artificialmente por el hombre, mediante colisiones entre distintos átomos.
Cuando la colisión se efectúa entre átomos y neutrones se obtienen átomos con idéntico número atómico, pero diferente peso molecular, a los que se les llama isótopos. El primero de ellos, el fósforo 30, fue preparado por Frédéric e Irene Joliot Curie en 1935.
Desde entonces, el hombre ha preparado más de 1 900 isótopos de diferentes elementos, muchos de ellos radiactivos.
Cualquier elemento natural o sintético es identificado por su número atómico Z, que corresponde al número de protones que lleva en su núcleo. Cada elemento puede tener un número variable de isótopos. El hidrógeno, que posee un protón y un electrón, tiene además un isótopo estable, cuyo núcleo está formado por un protón y un neutrón. A este isótopo con peso atómico de dos se le llama deuterio.
El uranio, que tiene número atómico de 92, posee 92 protones en su núcleo. Si además contiene 143 neutrones, estaremos en presencia del isótopo uranio 235 (143 + 92 = 235); cuando el número de neutrones es de 146, el isótopo de uranio será el 238.
Los diferentes isótopos (del griego, mismo lugar) de un elemento se llamarán, en general, de la misma manera y ocuparán el mismo lugar en la tabla periódica de los elementos, además de que tendrán idénticas propiedades químicas dado que su configuración electrónica permanece estable.
El carbono, elemento base de la vida, se encuentra en la corteza terrestre en una proporción de 0.03%, ya sea libre o formando parte de diversas moléculas. Como era de suponerse, el carbono se encuentra también en los demás planetas de nuestro Sistema Solar, ya que todos fueron formados a partir de la misma nebulosa. Se ha comprobado su existencia en meteoritos y en las muestras de piedras traídas de la Luna.
En la Tierra se le encuentra: libre en forma de diamante o de grafito; combinado, formando parte de diversas moléculas orgánicas como la celulosa de la madera, el algodón y el azúcar; formando parte de sustancias inorgánicas como el mármol, que químicamente es el carbonato de calcio (CaCO3), el bicarbonato de sodio o polvo de hornear (NaHCO3) y, en la atmósfera terrestre, como bióxido de carbono (C02), de donde las plantas lo toman y lo transforman, con la ayuda de la energía solar, en sustancias orgánicas que incorporan a su organismo. Estas sustancias serán posteriormente utilizadas por algunos de los seres del reino animal como alimento.
Éstos, a su vez, oxidarán la materia orgánica, liberando bióxido de carbono (CO2) para completar el ciclo de la vida.
EL METANO Y OTROS COMPUESTOS QUÍMICOS EN LOS CUERPOS CELESTES.
El metano formó parte de la atmósfera primitiva de la Tierra, donde se generó por la acción reductora del hidrógeno sobre el carbono. Era el gas predominante en la atmósfera terrestre de aquel entonces.
Actualmente el metano forma parte de la atmósfera de los planetas fríos que se encuentran más allá de Marte en nuestro Sistema Solar, es decir Júpiter, Neptuno, Urano y Plutón.
Las naves espaciales Pionero y Viajero I revelaron un mundo fascinante en que las capas de distintos colores se suceden en este enorme planeta, cuyo diámetro es 11 veces el de la Tierra. Como el metano se conserva en estado gaseoso, aun a 160° bajo cero, y solidifica sólo a -182°, se encuentra en forma de gas en la atmósfera de Júpiter, donde se transforma químicamente con la ayuda de la radiación ultravioleta del Sol. Las nuevas moléculas de hidrocarburos superiores más pesadas que el metano se licuan y llegan a solidificar precipitándose en forma de lluvia o nieve durante las tormentas eléctricas que se suceden con frecuencia en ese gigante del Sistema Solar. Los hidrocarburos superiores, constituidos por cadenas de átomos de carbono, al caer sobre el océano de hidrógeno líquido que cubre la superficie de Júpiter, son reducidos nuevamente al hidrocarburo más simple y más estable que es el metano, el que vuelve a incorporarse a la atmósfera joviana.
Saturno
El Viajero I llegó a Saturno en noviembre de 1980, después de su inspección por Júpiter y sus satélites, mostrando un enorme planeta, aunque algo menor que el anterior. Este planeta, que se distingue de los demás por su bello e impresionante sistema de anillos, posee una atmósfera en la que predomina el hidrógeno, aunque es rica también en metano, etano y amoniaco. Debido a la baja temperatura del planeta, el etano y el amoniaco se encuentran en estado sólido, y el helio se condensa cayendo como lluvia sobre la superficie del planeta.
Titán. Con este nombre se conoce a la mayor luna de Saturno, un cuerpo celeste con tamaño comparable al de la Tierra.
De gran importancia fueron los hallazgos de la primera misión del Viajero I, pues su espectrofotómetro de infrarrojos encontró que la atmósfera de este cuerpo celeste está formada por 80% de nitrógeno y por sustancias orgánicas como metano (CH4), etano (CH3 — CH3), acetileno (H — C C—H) y ácido cianhídrico (HC
C—H) y ácido cianhídrico (HC N).
N).
Debido a las bajas temperaturas que se alcanzan en Titán, 93°K (-l80°C) o menos, el metano puede existir en sus tres estados: sólido, líquido y gaseoso. En las capas superiores de Titán desciende la temperatura y el metano se congela formando pequeñas partículas sólidas. El metano produce en Titán algo similar a nuestras lluvias y nevadas.
Química del metano en las condiciones de Titán. Debido a que la atmósfera de Titán contiene también sustancias orgánicas provenientes de la reacción entre el metano y el nitrógeno, Titán se convierte en un excelente laboratorio químico extraterrestre donde se llevan a cabo reacciones químicas por medio de las cuales se forman ácido cianhídrico (HCN), ciano acetileno, etanopropano, etileno y metil acetileno. Muchas de estas sustancias, como el ácido cianhídrico, no habían sido detectadas en la atmósfera de otros planetas, aunque sí en el espacio interestelar.
La presencia de sustancias orgánicas nitrogenadas como el ácido cianhídrico y el ciano acetileno son de gran importancia científica, dado que son los intermediarios clave en la formación de los aminoácidos y ácidos nucléicos que son los precursores de la vida en la Tierra. Las demás lunas de Saturno no tienen atmósfera.
Urano y Neptuno
Son gigantescos planetas de color verde azulado, más fríos y densos que Saturno. La atmósfera de estos planetas contiene, además de hidrógeno, metano, identificado por su espectro de infrarrojo.
Urano. Es un gran planeta de color verdoso, con 51 000 km de diámetro (4 veces el de la Tierra), que circunda al Sol cada 84 años terrestres. Se encuentra a una distancia del Sol de 2 868 600 000 km (dos mil ochocientos sesenta y ocho millones seiscientos mil kilómetros), o sea 19 veces más alejado de lo que lo está la Tierra. Por tanto, a diferencia de los ocho minutos que tarda en llegar la luz solar a la superficie de la Tierra, a Urano llega después de poco más de dos horas y media. Esta enorme distancia convierte a Urano en un planeta difícil de estudiar.
Urano es un gigante gaseoso con un corazón rocoso, con 3 o 4 veces la masa de la Tierra, cubierto de una capa de agua, amoniaco y metano (H20, NH3 y CH4) de unos ± 8 000 km de espesor. Sobre este vasto océano existe una atmósfera de hidrógeno y de helio, con una considerable cantidad de metano.
Es precisamente el metano el que da un aspecto verdoso al planeta, ya que las ligadurasC—H absorben la luz roja. Las capas superiores de esta atmósfera se encuentran a —213 °C. La duración del día es aproximadamente de 114 horas terrestres.
Urano, a semejanza de Saturno, está rodeado de anillos, aunque éstos están constituidos por un material oscuro que refleja muy poco de la luz solar que reciben, por lo que quizá estén formados por sustancias derivadas del carbono.
Neptuno. Es, como Urano, un gigante verdoso con aproximadamente las mismas dimensiones y con una composición química parecida.
Plutón
Además de ser el más lejano y más pequeño de los planetas del Sistema Solar, es también el menos denso. Su composición química, según las últimas observaciones, queda así: agua sólida 74%, metano 5% y roca 21%.
Plutón, a pesar de ser tan pequeño, tiene una luna. Sin embargo, la gran lejanía impide hacer deducciones de la química de este pequeño y apartado cuerpo celeste.
La posibilidad de reacciones químicas entre las moléculas que forman la atmósfera de estos planetas es, debido al frío, muy restringida. El hidrógeno, que forma 90% de las atmósferas de Urano y Neptuno, no puede arder por la falta de oxígeno. Tampoco el metano, que se asemeja al gas de nuestras estufas, puede arder, pues falta el oxígeno necesario para que se efectúe la reacción de oxidación que sucede cuando encendemos nuestra estufa o el calentador de nuestro baño.
El otro elemento que se encuentra en la atmósfera de Urano y Neptuno es el helio, del que ya sabemos que es inerte. Es un elemento que por más que lo calentemos en presencia de oxígeno no arde, pues por tener completa su órbita de valencia no reacciona ni consigo mismo; es por esto que siempre se encuentra como átomo solitario (He).
En la atmósfera de Plutón se ha detectado metano, además de los gases nobles, argón y neón, razón por la cual su atmósfera es inerte. Por tanto, el metano en esas condiciones no podrá arder dando bióxido de carbono, agua, luz y calor, como lo hace en la Tierra.
LOS COMETAS
En los helados confines del Sistema Solar existen congelados millones de pequeños cuerpos celestes formados de hielo, gas y polvo. Cuando alguno de ellos es perturbado por el paso de una estrella, se pone en movimiento y, al recibir el calor del Sol, cobra vida, libera gases y polvo e inicia un viaje describiendo una órbita elíptica alrededor del Sol. A veces invierte miles de años en terminar este viaje. Mientras más se acerca al Sol en su recorrido, el cometa libera más materia, átomos y moléculas que, arrastradas por el viento solar, constituyen su cauda, la que, debido a dicho impulso, siempre se verá opuesta al Sol. Si en un camino alguno de los cometas se acerca demasiado al Sol, toda su materia se evapora, dando un espectáculo de luz antes de que sus átomos y moléculas pasen a formar parte de la materia invisible del Universo.
Las órbitas de algunos de ellos son alteradas por influencia de los grandes planetas, convirtiéndose en cometas de periodo corto, como es el caso del cometa Halley, que pasa por las cercanías de la Tierra cada 76 años.
Los cometas, después de haber sido observados a simple vista o por medio de telescopios y estudiados espectroscópicamente, se han descrito como pequeños cuerpos de hielo que mientras brillan a la luz del Sol emiten gases y polvo, y cuyas moléculas se descomponen en iones y radicales por acción del viento y radiación ultravioleta solares.
Aprovechando la ocasión en que el cometa Halley pasó por las cercanías de nuestro planeta en marzo de 1986, los científicos de todo el mundo unieron sus esfuerzos para estudiarlo, tanto para poder confirmar o rectificar los anteriores conceptos, como para desentrañar muchos de los misterios que aún lo rodean.
EL COMETA HALLEY
Las naves espaciales enviadas para su exploración y estudio por japoneses, soviéticos y europeos confirmaron muchos de los conceptos previamente establecidos, pero además revelaron datos sorprendentes, muchos de los cuales aún no han sido suficientemente estudiados.
De gran interés fue descubrir que su núcleo es alargado, con la forma de un cacahuate ennegrecido; que sus dimensiones son mayores de las que se habían supuesto. Tiene 15 kilómetros de largo por 10 de ancho en los lóbulos y siete en la parte más angosta, y que la superficie es intensamente oscura, una de las más oscuras que se conocen en cuerpos celestes, comparable a los anillos de Urano (tan solo refleja 4% de la luz solar que ilumina).
Así, ahora se sabe que el núcleo no es una brillante bola de hielo, sino una oscura bola de hielo y polvo cubierta de una delgada capa de un material oscuro constituido probablemente por derivados de carbono.
El espesor de la película es de solo 1 cm, según los científicos soviéticos que se basaron en datos enviados por las naves Vega 1 y Vega 2. Esta capa, aunque delgada, es suficiente para evitar en gran medida el reflejo de los rayos solares y al mismo tiempo la evaporación del agua.
Los sensores infrarrojos del Vega 1 detectaron una temperatura de 59°, temperatura más que suficiente para que el hielo sublime.
La costra tiene perforaciones por donde salen chorros de gas y polvo que se proyectan al espacio. Cuando menos siete chorros grandes y algunos pequeños se detectaron en la superficie del cometa.
Vega 1 determinó que se eliminan 10,000 kg de polvo cada segundo durante el máximo de la intensidad.
Los chorros de gas y polvo están constituidos principalmente por vapor de agua (80% en volumen), por lo que por este concepto se eliminan 5 000 kg de agua por segundo. Se encontró que junto con el agua se eliminan grandes cantidades de amoniaco (NH3, 10%) y metano (CH4, 7%), así como bióxido de carbono (CO2, 3.5%).
Los espectrómeros de masa instalados a bordo de la nave europea Giotto detectaron la presencia de una gran cantidad de partículas cargadas provenientes de la ruptura de moléculas tales como H — O., H+, H — O-, H· También detectaron la presencia de iones de carbono, oxígeno, sodio, azufre y fierro.
La nave japonesa Susei, que pasó el 8 de marzo a una distancia de 100 000 kilómetros del núcleo, encontró que el cometa respira hidrógeno: cada 53 horas sube la intensidad de hidrógeno debido al periodo de rotación, ya que en un momento dado presenta la cara que es sensible al Sol, pero al girar muestra la otra cara, dejando de eliminar hidrógeno.
MI OPINIÓN.
Lo que me pareció más importante de este capítulo fue que se mencionan los distintos espectros de luz que existen y como de entre todos ellos los únicos que vemos son los que van del violeta al rojo y los demás no los podemos ver otra cosa importante de este capítulo es como las plantas aprovechan la luz del sol para transformarla en energía química la cual le funciona como parte de su alimento, y como el hombre hace lo algo parecido pero para transformarla en energía eléctrica pero claro de una manera más ineficiente.
III. RADIACIÓN SOLAR, APLICACIONES DE LA RADIACIÓN, CAPA PROTECTORA DE OZONO, FOTOSÍNTESIS, ATMÓSFERA OXIDANTE, CONDICIONES APROPIADAS PARA LA VIDA ANIMAL.
E
N EL Sol se están generando constantemente grandes cantidades de energía mediante reacciones termonucleares. La energía radiante se propaga por el espacio viajando a razón de 300 000 km por segundo (velocidad de la luz, c). A esta velocidad, las radiaciones llegan a la Tierra ocho minutos después de ser generadas.
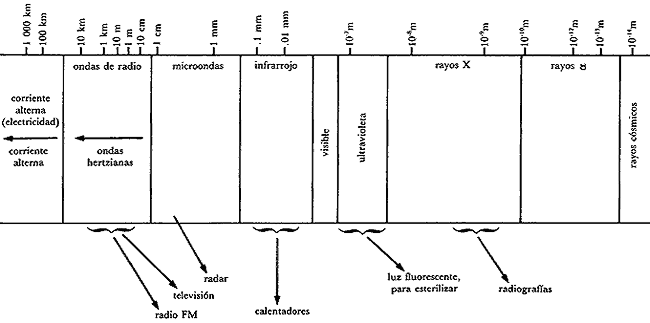
Las distintas radiaciones solares, de las cuales la luz visible es sólo una pequeña parte, viajan por el espacio en todas las direcciones, como los radios de un círculo, de donde proviene su nombre.
Debido a que las radiaciones viajan como ondas a la velocidad de la luz (c), tendrán como característica la longitud de onda (l), que es la distancia entre dos máximos.

El número de ondas que a una velocidad constante pasan por un determinado punto cada segundo se le llama frecuencia (v). Mientras menor sea la longitud de onda, más ondas pasarán cada segundo, siendo por lo tanto mayor la frecuencia, y cuando l es mayor, menos ondas pasarán y por tanto la frecuencia será menor, por lo que, a la velocidad de la luz (c), la frecuencia será inversamente proporcional a l.
Las radiaciones de mayor frecuencia tendrán también mayor energía, ya que la energía(E) es igual a la frecuencia y multiplicada por la constante de Plank (h), siendo h =6.626x10-34 J.s. La energía será, por lo tanto, E = hv.
La pequeña porción del espectro electromagnético que percibe el ojo humano es llamada "luz visible" y está compuesta por radiaciones de poca energía, con longitudes de onda (l)que van de 400 a 800 nm (nm = nanómetro = 10-7 cm). La luz de menor longitud de onda (l = 400 nm) es de color violeta; le sigue la de color azul; después tenemos la luz verde, seguida de la luz amarilla y la anaranjada y, por último, a 800 nm, la luz roja con la que termina el espectro visible.
Antes del violeta, es decir a longitudes de onda menores de 400 nm, existen radiaciones de alta energía que el ojo humano no puede percibir, llamadas ultravioleta. Otras radiaciones de alta energía, y por lo tanto peligrosas para la vida, son los llamados rayosX y las radiaciones gamma. Por su parte, a longitudes de onda mayores que la de la luz roja (800 nm) existen radiaciones de baja energía, llamadas infrarrojo, microondas y ondas de radio.
 |
El vapor de agua existente en la atmósfera primitiva de la Tierra estuvo expuesto a la radiación ultravioleta que durante millones de años llegó hasta la superficie terrestre sin dificultad. Las moléculas de agua eran descompuestas en hidrógeno (H2) y oxígeno (O2) por la alta energía del ultravioleta, el cual tiene una corta longitud de onda.
2H2O 2H2+O2
2H2+O2
A pesar de que la producción de oxígeno era constante, la naturaleza reductora de la atmósfera se conservaba, ya que gran parte del oxígeno generado era consumido en la formación de óxidos con los elementos de la corteza terrestre y produciendo agua y nitrógeno al reaccionar con el amoniaco que abundaba en la atmósfera terrestre.
Parte del oxígeno que ingresaba en la atmósfera era activado por la radiación ultravioleta y transformado en su alótropo, una forma de oxígeno de alta energía llamado ozono (03). De esta manera se fue formando una capa protectora contra la radiación ultravioleta que se situó a una altura de alrededor de 30 km sobre la superficie terrestre. Esta capa de ozono protege a la Tierra de las radiaciones ultravioleta que, debido a su alta energía, son dañinas para la vida, ya que excitan a átomos y moléculas a tal grado, que puede hacer que un electrón abandone al átomo. La luz ultravioleta, al activar los átomos moleculares, puede dar origen a radicales libres. Si estos radicales forman parte de un ser vivo, pueden causarle trastornos graves como cáncer y aun conducirlo a la muerte.
Otras radiaciones con mayor energía que la luz visible, como los rayos X, son también peligrosas para la vida. En cambio, cuando la luz visible incide sobre un átomo excitará sus electrones haciendo que avancen a un estado mayor de energía, del cual regresarán inmediatamente liberando la energía que habían absorbido en forma de luz con la misma frecuencia que tenía la que los excitó.
Cuando una molécula ha sido excitada, el fotón absorbido la hará pasar a un estado de mayor energía o estado excitado E*. Cuando esta molécula excitada se relaja a un subestado vibracional o rotacional de inferior energía, antes de que llegue a su estado basal emitirá luz a menor energía que la absorbida. Este proceso se llama fluorescencia.
REACCIONES FOTOQUÍMICAS
Un tercer camino para relajarla es cuando la molécula excitada da como resultado una reacción química o fotoquímica como, por ejemplo, en la reacción fotoquímica que se lleva a cabo en el proceso de la visión.
Un tercer camino para relajarla es cuando la molécula excitada da como resultado una reacción química o fotoquímica como, por ejemplo, en la reacción fotoquímica que se lleva a cabo en el proceso de la visión.
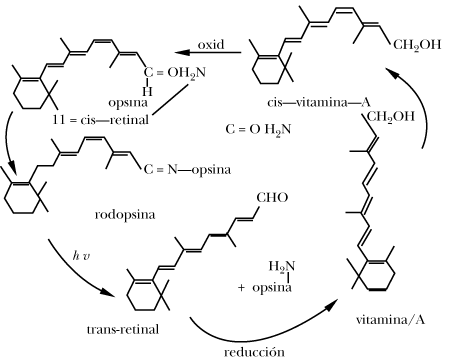
Cuando la luz llega a la retina, el retinal que forma parte de la rodopsina sufre una reacción fotoquímica por medio de la cual cambia su geometría a trans geometría que al no ser apropiada para unirse a la opsina provocará su separación y el color cambiará del rojo púrpura al amarillo.
El trans retinal enseguida se reduce enzimáticamente a vitamina A decolorándose totalmente. Después la vitamina A es transportada al hígado en donde se transforma en 11-cis-vitamina A. Ésta es ahora transportada al ojo en donde al ser oxidada se transforma en 11cis-retinal que se combina con la opsina para dar rodopsina e iniciar de nuevo el ciclo visual.
FOTOSÍNTESIS
En la fotosíntesis ocurre un proceso similar al descrito para las celdas fotovoltaicas. Aunque en aquélla no se produce una corriente eléctrica, es sin embargo más eficiente que el realizado en una celda fotovoltaica artificial.
En la fotosíntesis ocurre un proceso similar al descrito para las celdas fotovoltaicas. Aunque en aquélla no se produce una corriente eléctrica, es sin embargo más eficiente que el realizado en una celda fotovoltaica artificial.
La clave para tan alta eficiencia reside en la arquitectura molecular y en su asociación a membranas. Las membranas biológicas consisten en un fluido bicapa de lípidos anfipáticos especialmente fosfolípidos. La naturaleza anfipática de estos lípidos se debe a que presentan hacia el exterior la parte polar (cargada) de los fosfolípidos, la que es atraída hacia el medio acuoso. La parte interior de la membrana está constituida por las colas (no polares) de los fosfolípidos que forman una barrera entre los medios acuosos.
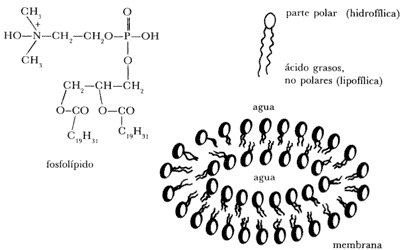
Figura 11.
Esta bicapa fosfolípida constituye una membrana y actúa como barrera semipermeable separando dos compartimientos acuosos (Figura 11). Por ejemplo, un glóbulo rojo está formado por una membrana que separa al citoplasma acuoso intracelular del plasma sanguíneo, que también es acuoso.
En los organismos fotosintéticos existen proteínas, colorantes y moléculas sensibilizadoras embebidas en la membrana de las células especializadas en la fotosíntesis.
En algas y plantas verdes, el aparato fotosintético se encuentra localizado en organelos intracelulares unidos a proteínas que se llaman cloroplastos.
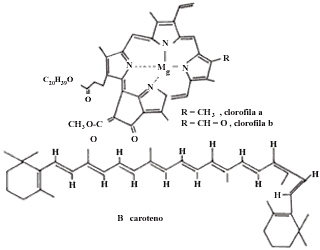
La molécula sensibilizadora en la fotosíntesis es la clorofila, molécula parecida a la del heme de la hemoglobina, que consiste en un anillo tetrapirrólico que contiene un átomo de Mg en el centro del anillo en vez del átomo de Fe que contiene el heme.
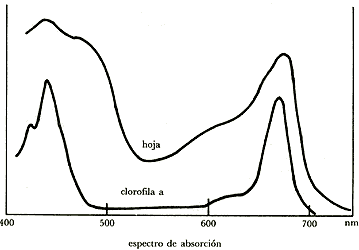
La clorofila absorbe luz para iniciar la reacción de fotosíntesis. La intensidad de absorción en las distintas l del espectro visible varían de acuerdo con la figura 12. Como en ella se ve, la clorofila absorbe en el azul y en el rojo y no en el verde, el cual es reflejado, razón por la que las hojas se ven verdes.
El aparato fotosintético consta de clorofila y una serie de pigmentos como carotenos y xantofilas, todos ellos unidos a una proteína embebida en una membrana, lo que permite una buena transmisión de energía.
Los pigmentos diferentes a la clorofila ayudan a absorber en las ls entre 450 y 650 nm, punto en que la clorofila es deficiente. Las cantidades y proporciones de pigmentos secundarios varía de planta a planta, siendo precisamente éstos los que le dan el color característico a las hojas. De aquí que se puedan encontrar de tono azulado, como en algunos eucaliptos; de tono amarillo, como en la lechuga, o de tono rojizo, como en algunos amarantos.
Los pigmentos que absorben la luz, situados en la membrana, se hallan dispuestos en conjuntos. Estos fotosistemas contienen alrededor de 200 moléculas de clorofila y algunas 50 de carotenoides. Todas las moléculas del conjunto pueden absorber luz, pero sólo una molécula de clorofila, combinada con una proteína específica, transforma la energía luminosa en energía química, por lo que recibe el nombre de centro de reacción fotoquímica. Todas las demás moléculas son colectoras o moléculas antena.
Las membranas de los cloroplastos poseen dos diferentes fotosistemas cada una, con su propio conjunto de moléculas colectoras y su centro de reacción. El fotosistema l, que absorbe a l mayores (800 nm), tiene una mayor proporción de clorofila a y el fotosistema II, que absorbe a l menores (680 nm), tiene mayor proporción de clorofila b.
Todas las plantas que desprenden oxígeno poseen ambos fotosistemas, siendo el agua oxidada en el lado derecho, como se muestra en la figura 13, y el NADP+ reducido en el lado izquierdo. Es también interesante notar que existen trampas de luz (fototrampas), oxidación de agua y reducción de NADP+. En la oxidación de H2O la molécula de clorofila sensibilizadora tiene un pico de absorción de luz a 680 nm y se designa como P680. El complejo total del lado de oxidación de H2O de la Z es llamado fotosistema II. Después de la absorción de energía luminosa se forma P680* (excitado), que por oxidación pasa aP680+ (oxidado), mientras se reduce un aceptor que es plastoquinona, acomplejada con heme sin fierro. El producto reducido es el radical libre de una hemequinona que ha sido identificado por resonancia spin electrón. La localización en la membrana del P680 y su plastoquinona proviene de la recombinación de cargas, pero el P680+ es también rápidamente reducido por los electrones tomados del agua. De hecho, después de cuatro eventos fotoquímicos se observa emisión de O2.
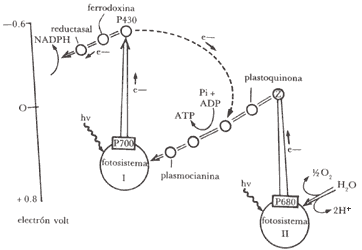
donde por cada electrón que proporciona el agua y recorre el camino hasta NADP+, se absorben dos cuantos de luz.
Para formar una molécula de O2 deben absorberse un total de ocho cuantos para cada fotosistema.
MI OPINION.
Lo que me pareció más importante de este capítulo fue que se mencionan los distintos espectros de luz que existen y como de entre todos ellos los únicos que vemos son los que van del violeta al rojo y los demás no los podemos ver otra cosa importante de este capítulo es como las plantas aprovechan la luz del sol para transformarla en energía química la cual le funciona como parte de su alimento, y como el hombre hace lo algo parecido pero para transformarla en energía eléctrica pero claro de una manera más ineficiente.
IV. VIDA ANIMAL, HEMOGLOBINA, ENERGÍA DE COMPUESTOS ORGÁNICOS, DOMINIO DEL FUEGO.
L
A CAPA de ozono formada por la acción de la luz ultravioleta dio a la Tierra una protección contra la alta energía de esta misma radiación, creándose así las condiciones apropiadas para la aparición de la vida. Las algas verde-azules y los vegetales perfeccionaron el procedimiento para combinar el CO2 atmosférico con el agua y los minerales del suelo con producción de materia orgánica y liberación de oxígeno que transformaría, en forma lenta pero segura, a la atmósfera terrestre de reductora en oxidante.
La química, que antes de la aparición de la vida se efectuaba en el planeta espontánea pero lentamente, ahora se acelera en forma notable. El oxígeno que se generaba por fotólisis del agua, ahora se libera de ésta en forma eficiente mediante la reacción de fotosíntesis, usando la luz solar como fuente de energía.
6 CO2 + 6 H2O 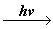 C6H12O6 + 6 O2
C6H12O6 + 6 O2
Por medio de la reacción anterior por una parte se acumuló en el planeta una gran cantidad de energía en forma de materia orgánica, y por otra la atmósfera se enriqueció en oxígeno, dándose así las condiciones para el nacimiento de un nuevo tipo de vida. Este nuevo tipo de vida realiza la operación contraria a la que efectúan los vegetales: toma la materia orgánica que elaboran los vegetales y por medio de una muy eficiente reacción de oxidación, para la que usa el oxígeno atmosférico, libera y utiliza la energía contenida en esas sustancias para realizar sus funciones. Posteriormente el bióxido de carbono formado en esa reacción regresa a la atmósfera, de donde podrá volver a ser empleado por los vegetales y continuar el eterno ciclo.
Como se vio en el capítulo anterior, los vegetales usan el pigmento verde llamado clorofila como catalizador indispensable en la reacción de fotosíntesis. Por medio de esta reacción los vegetales acumulan 686 kilocalorías en cada molécula de glucosa.
Los organismos animales, para realizar la reacción de oxidación y liberar las 686 kilocalorías contenidas en la molécula de glucosa, utilizan como transportador de oxígeno un pigmento asociado con proteína conocido como hemoglobina. Este pigmento tiene el mismo esqueleto básico de la clorofila, pero difiere esencialmente en el metal que contiene, pues mientras que la clorofila (figura 14(a)) contiene magnesio, la hemoglobina (figura 14(b)) contiene fierro.
La hemoglobina toma oxígeno del aire y lo transporta a los tejidos, que es donde se realiza la reacción contraria a la fotosíntesis.
De esta manera, el CO2 que los vegetales toman de la atmósfera regresa a ella. En estas condiciones, los diferentes tipos de animales, incluyendo al hombre que llegó un poco más tarde, vivían en perfecto equilibrio con la naturaleza, pues éste sólo consumía alrededor de 2 000 kilocalorías por día, es decir sólo la energía necesaria para mantener su cuerpo saludable.
La hemoglobina es una cromoproteína compuesta por una proteína, la globina, unida a una molécula muy parecida a la clorofila, pero que, en vez de magnesio, contiene fierro; el oxígeno se le une en forma reversible. Cuando la hemoglobina está unida a oxígeno se llama oxihemoglobina y cuando lo ha soltado deoxihemoglobina.

El fierro necesario para la formación de hemoglobina el ser humano lo toma en su dieta a razón de 1 miligramo por día, acumulándose normalmente 4 gramos de él en los adultos. Es decir, un ser humano adulto tendría fierro suficiente como para elaborar un clavo de 4 centímetros de largo.
Otro mineral que el organismo humano requiere en cantidades apreciables es el muy común metal alcalino térreo llamado calcio, cuyos compuestos son bien conocidos. Ejemplo de esto son la cal y el mármol.
La cantidad de calcio que un adulto necesita ingerir diariamente en su dieta es de alrededor de 1 gramo, es decir, la cantidad que corresponde al contenido de calcio en un trozo de mármol de 2.5 gramos.
El fósforo es otro de los elementos indispensables para el funcionamiento del organismo humano por lo que requiere ingerir diariamente en los alimentos alrededor de 1 gramo.
Pero volvamos al fierro. Una vez que éste ha sido asimilado, cada átomo permanecerá en el organismo por un tiempo aproximado de 10 años, durante los cuales pasará por muy diversos estados metabólicos, combinándose con diferentes sustancias y realizará muchos procesos, entre los cuales está uno sumamente importante para el organismo humano: el de transportar oxígeno a los tejidos. Un gramo de hemoglobina se combina con 1.35 mililitros de oxígeno.
El monóxido de carbono (CO), gas que se desprende del escape de los automóviles y en combustiones incompletas como la del carbón vegetal, se combina con la hemoglobina desplazando al oxígeno para dar un compuesto más estable. En esta forma el CO evita que se lleve a cabo la función del organismo, la cual puede provocar la muerte cuando la cantidad de este gas que se ha fijado es grande.
La hemoglobina se encuentra dentro de las células rojas o eritrocitos, que tienen una vida media de 120 a 180 días. Éstos son devorados posteriormente por células del sistema retículo endotelial. Estas células, llamadas macrófagos (devoradoras de objetos grandes), se encuentran principalmente en el bazo, el hígado y la médula ósea. El macrociclo de la hemoglobina es cortado oxidativamente por una de las dobles ligaduras para dar el complejo biliverdina-hierro-proteína. El hierro se elimina al igual que la proteína para dar biliverdina, la que es luego reducida para dar origen a la bilirrubina. El hierro libre se combina con proteína del plasma y es transportado a depósitos en la médula ósea, donde se vuelve a usar para formar nueva hemoglobina.
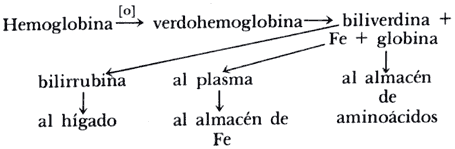
De esta manera, el Fe completa su ciclo en su importante misión de ser el elemento clave en el transporte de oxígeno para realizar la reacción de oxidación de los alimentos, de la que se deriva la energía necesaria para el mantenimiento de la vida animal saludable.
LOS ANIMALES Y EL HOMBRE
De todos los animales que poblaron el planeta hubo uno que destacó por tener un cerebro mayor que los demás: el hombre. Aunque más débil que otros animales de su mismo peso, que competían con él por alimentos y espacio, fue poco a poco dominando su entorno vital gracias a su cerebro superior, que le permitía aprender y asimilar experiencia.
De todos los animales que poblaron el planeta hubo uno que destacó por tener un cerebro mayor que los demás: el hombre. Aunque más débil que otros animales de su mismo peso, que competían con él por alimentos y espacio, fue poco a poco dominando su entorno vital gracias a su cerebro superior, que le permitía aprender y asimilar experiencia.
El cerebro es un órgano maravilloso que distingue al hombre de los demás animales y lo ha llevado a dominar el planeta y, más aún, a conocer otros mundos.
Siendo el cerebro un órgano tan importante, es lógico que sea alimentado en forma privilegiada en relación con los demás órganos del cuerpo. El cerebro recibe glucosa pura como fuente de energía, y para su oxidación usa casi el 20% del oxígeno total que consume un ser humano adulto.
El cerebro de un adulto requiere más de 120 gramos de glucosa por día, misma que puede provenir de precursores tales como el piruvato y los aminoácidos.
La glucosa es aprovechada por el cerebro vía secuencia glicolítica y ciclo del ácido cítrico, y el suministro de
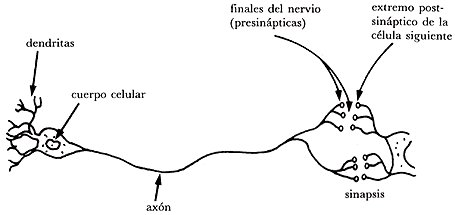
ATP es generado por catabolismo de glucosa. La energía de ATP se requiere para mantener la capacidad de las células nerviosas (neuronas) manteniendo así el potencial eléctrico de las membranas del plasma, en particular de aquellas que rodean el largo proceso en que intervienen axones y dendritas, que son las que forman la línea de transmisión del sistema nervioso (Figura 15).
El cerebro gobierna las emociones y el dolor por medio de reacciones químicas. La química del cerebro es muy complicada y no es bien conocida todavía; sin embargo, es muy interesante la relación que existe entre los efectos del alcaloide morfina, el alivio del dolor y las sustancias naturales del cerebro llamadas endorfinas y encefalinas.
ENVEJECIMIENTO
Indudablemente, mientras más tiempo ha durado un objeto inanimado, su aspecto más se deteriora. Así, por ejemplo, los objetos de hierro que fueron bellos y brillantes, pronto pierden su brillo y tarde o temprano se cubren de la herrumbre que los corroe; los objetos de hule se vuelven quebradizos; lo mismo pasa con los bellos objetos de piel, que con el tiempo se deterioran volviéndose quebradizos porque se avejentan. Procesos todos ellos en que mucho tiene que ver el oxígeno: el hierro se oxida con el tiempo, al igual que el hule y el cuero que lo fueron en su proceso de envejecimiento. El aspecto de los seres vivos cambia también con el tiempo: se hacen viejos. El tiempo que se mide por el número de días, meses y años transcurridos, bien podría medirse por el número de respiraciones o por el volumen de oxígeno que ha usado el cuerpo desde su nacimiento hasta su muerte.
Indudablemente, mientras más tiempo ha durado un objeto inanimado, su aspecto más se deteriora. Así, por ejemplo, los objetos de hierro que fueron bellos y brillantes, pronto pierden su brillo y tarde o temprano se cubren de la herrumbre que los corroe; los objetos de hule se vuelven quebradizos; lo mismo pasa con los bellos objetos de piel, que con el tiempo se deterioran volviéndose quebradizos porque se avejentan. Procesos todos ellos en que mucho tiene que ver el oxígeno: el hierro se oxida con el tiempo, al igual que el hule y el cuero que lo fueron en su proceso de envejecimiento. El aspecto de los seres vivos cambia también con el tiempo: se hacen viejos. El tiempo que se mide por el número de días, meses y años transcurridos, bien podría medirse por el número de respiraciones o por el volumen de oxígeno que ha usado el cuerpo desde su nacimiento hasta su muerte.
El hule de las llantas envejece, lo que se retarda con la vulcanización y adición de antioxidantes; los aceites y grasas se hacen rancios por efecto del oxígeno del aire, proceso que se logra detener por adición de antioxidantes como el tocoferol (vitamina E) y el ácido ascórbico o vitamina C, entre los de origen natural, que son muy importantes.
Los radicales libres están implicados en el proceso del envejecimiento del ser humano. Un intermediario clave es el superóxido O-O , formado por reducción del 02 molecular por varios reductores in vivo,
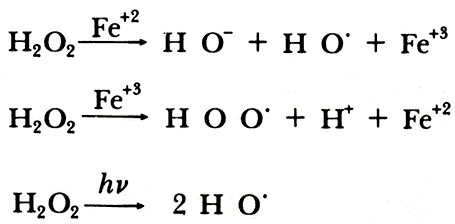
Los antioxidantes son importantes en el tejido canceroso en donde la concentración de tocoferol es mayor que en tejido normal. Son también importantes en la prevención de oxidación de lípidos en los tejidos.
El envejecimiento biológico puede ser debido al ataque de radicales hidroxilo H O. sobre las células no regenerables del cuerpo. Estos radicales pueden provenir de generación indeseable en la cadena alimenticia o por irradiación ultravioleta u otra radiación de alta energía.
Se puede entonces pensar que los antioxidantes detendrán el envejecimiento; el problema es que muchos antioxidantes sintéticos, aunque más eficaces in vitro que los biológicos, producen reacciones secundarias indeseables en el organismo.
MI OPINIÓN.
Lo que me parece más relevante de este capítulo es que se menciona como el hombre logra el dominio de uno de las mayores herramientas que el hombre ha usado para su beneficio y con el cual se protegió de los animales, del frio y como lo utilizo para cocinar sus alimentos y también se mencionan algunas sustancias como el opio que interfería con los procesos naturales del cuerpo, y también se menciona el uno de los órganos más importantes de nuestro cuerpo el cerebro.
V. IMPORTANCIA DE LAS PLANTAS EN LA VIDA DEL HOMBRE: USOS MÁGICOS Y MEDICINALES.
U
NA vez que el hombre aprendió a dominar el fuego, estuvo en condiciones de fabricar recipientes de arcilla, los que, endurecidos por el fuego, le servirán para calentar agua, cocinar alimentos y hacer infusiones mágicas y medicinales. De esta manera los aceites esenciales arrastrados por el vapor de agua aromatizaban la caverna y se condensaban en el techo, con lo que se separaban las sustancias químicas contenidas en las plantas. El químico primitivo encontró que los aceites esenciales no solo tenían olor agradable, sino que muchos de ellos tenían además propiedades muy útiles, como eran las de ahuyentar a los insectos y de curar algunas enfermedades.
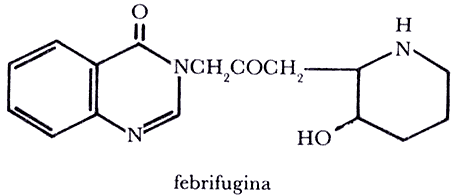
El conocimiento de las plantas y sus propiedades seguía avanzando: ya no sólo las usaba el hombre como alimentos, combustible y material de construcción, sino también como perfume, medicinas y para obtener colorantes, que empleaba tanto para decorar su propio cuerpo y sus vestiduras, como para decorar techo y paredes de su cueva. El arte pictórico floreció en ese entonces en muchas partes del mundo y actualmente nos asombran sus manifestaciones conservadas en oscuras cavernas, donde con frecuencia se ven escenas de cacería. Es evidente que la necesidad de alimentación era primordial y que los testimonios del uso medicinal de las plantas son menos frecuentes; sin embargo, los chinos han dejado constancias escritas desde hace más de 4 000 años acerca del uso antimalárico de la droga chaáng shan que corresponde a la planta Dichroa febrifuga, Lour. Los estudios modernos han demostrado la existencia en esa planta del alcaloide antimalárico llamado febrifugina.
Los pueblos americanos tenían a la llegada de los españoles un amplio conocimiento de las plantas y sus propiedades, especialmente medicinales. Tan impresionante era la variedad de plantas que crecían en el nuevo mundo y tan notable el conocimiento que de ellas tenían los pueblos nativos que lograron interesar vivamente al rey de España.
La primera obra que se conoce al respecto es debida al médico indígena Martín de la Cruz, quien la escribe en lengua náhuatl durante el año de 1552. La traducción al latín hecha por Juan Badiano, denominada Libellus de medicinalibus indorum herbis, se conoce gracias a que Charles Upson Clark la encontró en la Biblioteca Barberini durante los estudios que realizó en Roma de 1916 a 1919.
Este opúsculo consta de bellas ilustraciones al estilo de los antiguos artistas indígenas confeccionadores de códices (tlacuilos). Sobre las ilustraciones viene el nombre de la planta y debajo se encuentra el nombre de la enfermedad que cura, seguida de una receta detallada conteniendo el modo de administrarse.
El rey de España, Felipe II, al tener noticias de que en la Nueva España existían más plantas y semillas medicinales que en ninguna otra parte del mundo, envió a Francisco Hernández, "protomédico e historiador general de las Indias, Islas y tierra firme del mar océano", para que emprendiera una investigación médico-botánica en los vastos territorios recientemente incorporados a la Corona.
Francisco Hernández llega al Nuevo Mundo con las instrucciones de identificar todas las yerbas, árboles y plantas medicinales que hubiere en la provincia donde se encontrase y de averiguar qué enfermedades curaban y la manera de hacerlo.
Este estudio culminó con la descripción de 3 076 plantas y sus usos medicinales. Francisco Hernández no se limitó al estudio de plantas, sino que hizo también un amplio recuento de los animales y minerales de la Nueva España.
Los estudios de los minerales de la Nueva España sentaron la base del impresionante auge de la industria metalúrgica mexicana, especialmente en el ramo de metales preciosos. La descripción del chapopotli señala por primera vez la existencia de petróleo en el territorio de la actual República Mexicana.
Los estudios botánicos, por su parte, sirvieron de base a estudios posteriores por medio de los cuales ha sido posible la identificación botánica de más de mil de las plantas descritas por Francisco Hernández.
DROGAS ESTIMULANTES CON FINES MÁGICOS Y RITUALES
Muchas plantas fueron utilizadas en ritos mágico-religioso y muchas de ellas continúan en uso hasta nuestros días.
Muchas plantas fueron utilizadas en ritos mágico-religioso y muchas de ellas continúan en uso hasta nuestros días.
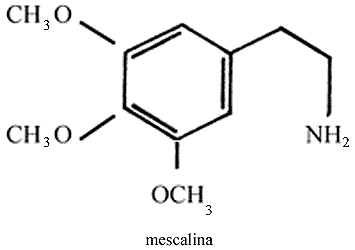
El peyote, empleado por los pueblos del Noroeste, se sigue usando en la actualidad y se le considera una planta divina. Cuando este cactus es comido, da resistencia contra la fatiga y calma el hambre y la sed, además de hacer entrar al individuo a un mundo de fantasías, que lo hace sentir la facultad de predecir el porvenir. En busca de tan maravillosa planta los huicholes hacen peregrinaciones anuales, desde sus hogares en el norte de Jalisco y Nayarit, hasta la región desértica de Real de Catorce en San Luis Potosí, que es donde crece este cactus. Los efectos del peyote duran de seis a ocho horas y terminan de manera progresiva hasta su cese total.
Su empleo entre los indígenas no se debe a hábito, sino que obedece a ritos religiosos. El principio activo del peyote (Anhalonium Williamsi) es el alcaloide llamado mescalina.
VI. FERMENTACIONES, PULQUE, COLONCHE, TESGÜINO, POZOL, MODIFICACIONES QUÍMICAS.
M
UCHOS microorganismos son capaces de provocar cambios químicos en diferentes sustancias, especialmente en carbohidratos. Es de todos conocido el hecho de que al dejar alimentos a la intemperie en poco tiempo han alterado su sabor y, si se dejan algún tiempo más, la fermentación se hace evidente comenzando a desprender burbujas como si estuviesen hirviendo. Esta observación hizo que el proceso fuese denominado fermentación (de fervere, hervir). Esta reacción, que ocurre en forma espontánea, provocada por microorganismos que ya existían o que cayeron del aire, hacen que la leche se agrie, que los frijoles se aceden y otros alimentos se descompongan, y que el jugo de piña adquiera sabor agrio y llegue a transformarse en vinagre.
Estos hechos fueron conocidos desde las épocas más remotas, siendo quizá la fermentación el proceso químico más antiguo que el hombre pudo controlar. Éste observó que las uvas con el tiempo adquirían un cierto sabor al que llegó a aficionarse; así, el vino llegó a producirse en la región del Tigris y en Egipto desde hace ya varios miles de años. Los mercaderes griegos llevaron la uva y su cultivo a Marsella desde 600 años a.C. y su cultivo se extendió hasta el Rin desde 200 años a. C.
El vino se convirtió en la bebida preferida de los pueblos mediterráneos, quienes la conservan hasta hoy y la han extendido a todo el mundo.
FERMENTACIÓN ALCOHÓLICA
La fermentación alcohólica producida por levaduras ha sido utilizada por todos los diferentes pueblos de la Tierra.
La fermentación alcohólica producida por levaduras ha sido utilizada por todos los diferentes pueblos de la Tierra.
En la obtención industrial de etanol se usan diversos sustratos; entre ellos, uno de los principales son las mieles incristalizables que quedan como residuo después de la cristalización del azúcar en los ingenios.
Muchos sustratos con alto contenido de azúcares y almidones se utilizan en la preparación de bebidas alcohólicas como la cerveza, que tiene muy amplio consumo en el ámbito mundial. Pero no sólo para la producción de alcohol o vino se emplea la levadura, un empleo muy antiguo y actualmente generalizado en el mundo entero es la fabricación de pan.
El uso de la levadura en la fabricación del pan fue descubierto por los egipcios varios siglos antes de Cristo. El historiador griego Herodoto menciona su empleo en las panaderías egipcias desde 500 años antes de Cristo.
Al mezclarse la levadura con la masa de harina se lleva a cabo una fermentación por medio de la cual algunas moléculas de almidón se rompen para dar glucosa, la que se sigue fermentando hasta dar alcohol y bióxido de carbono (CO2). Es este gas el que esponja la masa de harina y hace que el pan sea suave y esponjoso. De no haber puesto levadura, el pan hubiese tenido la consistencia de una galleta. Junto con el alcohol se producen algunos ácidos que le imparten al pan su muy apreciado sabor.
OTROS PRODUCTOS OBTENIDOS POR FERMENTACIÓN
Fermentación láctica
La leche es fermentada por varios microorganismos tales como Lactobacillus casei, o por cocos como el Streptococcus cremoris, transformándose en alimentos duraderos como yogur y la gran variedad de quesos tan preciados en la mesa.
Fermentación láctica
La leche es fermentada por varios microorganismos tales como Lactobacillus casei, o por cocos como el Streptococcus cremoris, transformándose en alimentos duraderos como yogur y la gran variedad de quesos tan preciados en la mesa.
La acidez de la leche fermentada se debe al ácido láctico que se forma por la transformación de los azúcares de la leche (de la lactosa). Este mismo tipo de fermentación es el que sufre la col en la preparación del sauerkraut de tan amplio consumo en la mesa de los pueblos europeos.
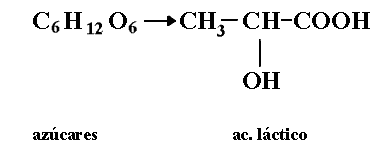
Las fermentaciones pueden ser provocadas por muy diversos microorganismos, por lo que las transformaciones pueden seguir distintos caminos y, por lo tanto, obtenerse diferentes productos, tales como ácido butírico, butanol, acetona, isopropanol, ácido propiónico y muchos otros más.
El químico se ha dado cuenta de la gran utilidad que pueden prestar los microorganismos al efectuar transformaciones de un producto en otro y sobretodo al realizar cambios parciales en algunas moléculas, cambios que por medios químicos son muy difíciles de llevar a cabo, debido a la necesidad de gastar mucho tiempo y reactivos, además de obtener pobres rendimientos.
Muchas de estas difíciles reacciones las realizan los microorganismos en poco tiempo y con excelentes rendimientos.
La primera transformación química en esteroides fue efectuada por Mamoli y Vancellone en 1937. Ellos obtuvieron testosterona, la hormona masculina, a partir de androstenolona. El proceso se hizo en dos pasos: primero, se efectuó la oxidación de androstenolona por agitación de la sustancia finamente dividida en suspensión en agua adicionada de fosfato. En esta suspensión la levadura trabaja oxidando al esteroide por medio del oxígeno del aire durante dos días.
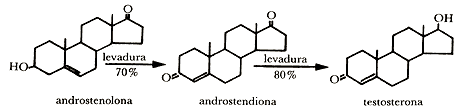
Segundo, la androstenediona así obtenida se separa y se hace fermentar con levadura que trabaja en una solución azucarada. En este paso el microorganismo reduce selectivamente un carbonilo y produce la hormona masculina, la testosterona.
Así pues, como en el ejemplo anterior, los microorganismos hacen oxidaciones y reducciones selectivas para obtener sustancias tan valiosas como la hormona testosterona.
El grupo de investigación de los laboratorios Upjohn empleó en 1952 un cultivo del hongoRhizopus nigricans para introducir un grupo alcohol (OH) a la progesterona y producir la 11a-hidroxiprogesterona.
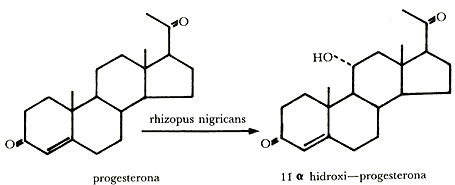
La introducción del grupo hidróxido en la posición 11a de la progesterona es un paso clave en la ruta hacia los corticoides, que son sustancias con importantes actividades biológicas que las hacen útiles en medicina. Entre los corticoides más conocidos podemos mencionar a la cortisona y a la dihidrocortisona.
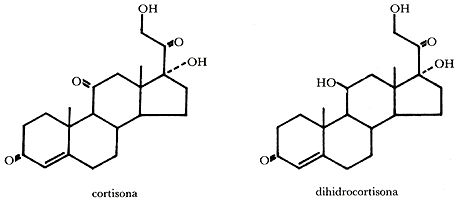
Ambas sustancias son útiles en el tratamiento de múltiples enfermedades, como artritis reumatoide, inflamaciones de la piel, enfermedad de Addison, asma, etcétera.
El uso de los microorganismos en la obtención de nuevos productos y en la modificación de algunas moléculas es tan amplia, que su descripción llena libros y grandes colecciones especializadas. Aquí sólo hemos dado unos cuantos ejemplos que quizá despierten el interés del lector que podrá acudir a ellas para obtener mayor información.
MI OPINIÓN.
Este capítulo fue de los que más me gusto porque se menciona en primera una bebida importante del pueblo Mexicano el pulque que se obtiene por medio de la fermentación del aguamiel que se obtiene de el maguey, así como se menciona el pulque se mencionan otras bebidas importantes de nuestro país pero no solo eso sino que también se encuentran otras como el yogurt, el vino, el pan y como la fermentación actúa en ellos.
VII. JABONES, SAPONINAS Y DETERGENTES.
M
UCHAS veces hemos visto maravillados cómo en una fría mañana invernal los patos nadan en el estanque sin una aparente preocupación por ser mojados por las frías aguas; cuando por fin dejan el estanque, simplemente se sacuden de las gotas superficiales y su plumaje queda tan seco como antes de su contacto con el agua. Al observar las aguas estancadas es frecuente ver insectos que con gran seguridad van y vienen corriendo sobre la superficie del agua. Ambos fenómenos tienen que ver con el hecho muy conocido de que el agua y el aceite no se mezclan.
Tanto el cuerpo del insecto como el plumaje de los patos se encuentran cubiertos por una capa de grasa que los hace impermeables.
Cuando la ropa u otros objetos se manchan con grasa y tratamos de lavarlos con agua sucederá lo mismo que con el plumaje de los patos: el agua no moja a la mancha de aceite. El agua, por lo tanto, no sirve para limpiar objetos sucios con aceites o grasas; sin embargo, con la ayuda de jabón o detergente sí podemos eliminar la mancha de grasa. El efecto limpiador de jabones y detergentes se debe a que en su molécula existe una parte lipofílica por medio de la cual se unen a la grasa o aceite, mientras que la otra parte de la molécula es hidrofílica, tiene afinidad por el agua, por lo que se une con ella; así, el jabón toma la grasa y la lleva al agua formando una emulsión (Figura 16).
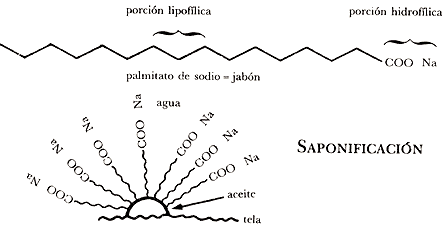
SAPONIFICACIÓN
Los jabones se preparan por medio de una de las reacciones químicas más conocidas: la llamada saponificación de aceites y grasas.
Los jabones se preparan por medio de una de las reacciones químicas más conocidas: la llamada saponificación de aceites y grasas.
Los aceites vegetales, como el aceite de coco o de olivo, y las grasas animales, como el sebo, son ésteres de glicerina con ácidos grasos. Por eso cuando son tratados con una base fuerte como sosa o potasa se saponifican, es decir producen la sal del ácido graso conocida como jabón y liberan glicerina. En el caso de que la saponificación se efectúe con sosa, se obtendrán los jabones de sodio, que son sólidos y ampliamente usados en el hogar. En caso de hacerlo con potasa, se obtendrán jabones de potasio, que tienen consistencia líquida.
La reacción química que se efectúa en la fabricación de jabón se puede representar en forma general como sigue:
| CH2—O—CO—R | CH2—OH | |||||
| | | | | |||||
| CH—O—CO—R | + | 3 NaOH |  | CH—OH | + | 3 R—CO—ONa |
| | | | | |||||
| CH2—O—CO—R | CH2—OH | |||||
| Aceite | + | sosa |  | glicerina | + | jabón |
Con frecuencia se agrega brea en el proceso de saponificación obteniéndose así jabones en los que, junto con las sales de sodio de ácidos grasos, se tendrá la sal de sodio de ácidos resínicos, lo que los hace más solubles y más apropiados para lavar ropa. Evidentemente se podrán obtener sales de ácidos grasos con otros metales, especialmente con calcio, ya que el hidróxido más abundante y barato es la cal,Ca(OH)2. Ahora bien, si la saponificación se hace con cal, el producto será el jabón de calcio, Ca(OCOR)2. El problema es que este jabón es un sólido duro e insoluble, por lo que no sirve para los fines domésticos a los que se destinan los jabones de sodio.
Los jabones de sodio tienen un amplio uso en nuestra civilización, por lo que la industria jabonera es una de las más extensamente distribuidas en el mundo entero.
FABRICACIÓN DE JABÓN
El proceso de fabricación de jabón es, a grandes rasgos, el siguiente: se coloca el aceite o grasa en un recipiente de acero inoxidable, llamado paila, que puede ser calentado mediante un serpentín perforado por el que se hace circular vapor. Cuando la grasa se ha fundido ±8Oº, o el aceite se ha calentado, se agrega lentamente y con agitación una solución acuosa de sosa. La agitación se continúa hasta obtener la saponificación total. Se agrega una solución de sal común (NaCl) para que el jabón se separe y quede flotando sobre la solución acuosa.
El proceso de fabricación de jabón es, a grandes rasgos, el siguiente: se coloca el aceite o grasa en un recipiente de acero inoxidable, llamado paila, que puede ser calentado mediante un serpentín perforado por el que se hace circular vapor. Cuando la grasa se ha fundido ±8Oº, o el aceite se ha calentado, se agrega lentamente y con agitación una solución acuosa de sosa. La agitación se continúa hasta obtener la saponificación total. Se agrega una solución de sal común (NaCl) para que el jabón se separe y quede flotando sobre la solución acuosa.
Se recoge el jabón y se le agregan colorantes, perfumes, medicinas u otros ingredientes, dependiendo del uso que se le quiera dar. El jabón se enfría y se corta en porciones, las que enseguida se secan y prensan, dejando un material con un contenido de agua superior al 25%.
MI OPINIÓN.
Este capítulo es donde se mencionan los jabones que son productos importantes para nuestra vida cotidiana el jabón, el jabón es un producto que nosotros utilizamos para la limpieza pero lo interesante es su fabricación la cual se efectúa con grasa o aceite el cual al ser calentado cuando se le agregan sustancias como la sosa caustica se transforma en el jabón, también se menciona el detergente y los problemas ambientales que representa ya que este contamina demasiado, lo que me pareció mas interesante fue que en la antigüedad tenían un jabón que provenía de una planta.
VIII. HORMONAS VEGETALES Y ANIMALES, FEROMONAS, SÍNTESIS DE HORMONAS A PARTIR DE SUSTANCIAS VEGETALES.
L
AS PLANTAS no sólo necesitan para crecer agua y nutrientes del suelo, luz solar y bióxido de carbono atmosférico. Ellas, como otros seres vivos, necesitan hormonas para lograr un crecimiento armónico, esto es, pequeñas cantidades de sustancias que se desplazan a través de sus fluidos regulando su crecimiento, adecuándolos a las circunstancias. Cuando la planta germina, comienzan a actuar algunas sustancias hormonales que regulan su crecimiento desde esa temprana fase: las fitohormonas, llamadas giberelinas, son las que gobiernan varios aspectos de la germinación; cuando la planta surge a la superficie, se forman las hormonas llamadas auxinas, las que aceleran su crecimiento vertical, y, más tarde, comienzan a aparecer las citocininas, encargadas de la multiplicación de las células y que a su vez ayudan a la ramificación de la planta.
La existencia de auxinas fue demostrada por F. W. Went en 1928 mediante un sencillo e ingenioso experimento, que consiste a grandes rasgos en lo siguiente: a varias plántulas de avena recién brotadas del suelo se les cortaba la punta, que contiene una vainita llamada coleóptilo; después del corte, la planta interrumpía su crecimiento. Si a alguna planta decapitada se le volvía a colocar la puntita, se notaba que reanudaba su crecimiento, indicando que en la punta de las plántulas de avena existía una sustancia que la hacía crecer.
Esta demostración estimuló a varios investigadores en la búsqueda de la sustancia que hacía crecer a las plántulas de avena y probablemente a otras plantas.
Una sustancia estimulante del crecimiento de avena fue aislada de orina en 1934 por Kögl y Haagen-Smit. La sustancia activa fue identificada como ácido indol acético.
La misma sustancia fue aislada en 1934 por Haagen-Smit, como producto natural a partir de maíz tierno.
La manera en que las auxinas hacen crecer a la planta es por medio del aumento del volumen celular provocado por absorción de agua.
No son las auxinas las únicas fitohormonas que requiere una planta para su crecimiento; requieren también de otro tipo de ellas que favorezca la multiplicación de las células. El primero en demostrar la existencia de estas sustancias, que se conocen como citocininas, fue Carlos O. Miller, quien observó que, al poner cubitos de zanahoria o papa en agua de coco, éstos crecían con proliferación de células.
Al no poder aislar la hormona presente en el agua de coco por ser muy inestable, determinó sus características espectroscópicas. La absorción en la región del ultravioleta fue muy parecida a la del ácido ribonucleico, lo que hizo pensar en la posible actividad hormonal de este ácido. Efectivamente, al ser probado el ácido ribonucleico contenido en un frasco almacenado por largo tiempo en el laboratorio, se observó notable actividad hormonal. Cuando el contenido del viejo frasco se terminó se probaron ácidos ribonucleicos recientemente preparados, aunque con resultados decepcionantes, ya que el ácido ribonucleico nuevo no tenía actividad hormonal.
Los resultados anteriores fueron explicados pensando en que la sustancia responsable de la actividad hormonal no fuese el
ARN, sino un producto de su descomposición. Y efectivamente esta hipótesis fue probada al poder separar de ARN viejo una sustancia con actividad multiplicadora de células, a la que se llamó cinetina.
Este descubrimiento sirvió de estímulo para que años más tarde se aislara de maíz tierno la hormona natural llamada zeatina, cuya estructura no difiere mucho de la cinetina obtenida como producto de descomposición de ácido ribonucleico.
Conociendo la existencia de auxinas que hacen crecer a la planta por agrandamiento de sus células y la presencia de citocininas que favorecen la división celular, tendríamos la posibilidad de lograr plantas con crecimiento ilimitado, pero esto no sucede así, la planta contiene también inhibidores, sustancias que actúan cuando las condiciones dejan de ser favorables para el crecimiento ya sea por escasez de agua o por frío.
Todos hemos observado que en invierno las plantas dejan caer sus hojas y que, aunque el invierno no sea muy crudo, debido a la escasez de agua, la planta suelta su follaje.

Su descubrimiento fue anunciado en 1956 por tres grupos de científicos que, trabajando independientemente, llegaron a descubrirlo. Estos tres grupos de investigadores —uno, el grupo inglés, encabezado por Rothwell K.; otro, el australiano, por Waring, y el tercero, el estadunidense, encabezado por Addicot— llevaron su descubrimiento al Congreso, llamado "Régulateurs Natureles de la Croissance Végétal", celebrado en París en 1964.
Con el descubrimiento del inhibidor del crecimiento, el ácido abscísico, se tiene un buen panorama de la regulación del crecimiento de las plantas; sin embargo todavía estamos muy lejos de conocer las funciones de muchas de las sustancias químicas que elaboran los vegetales. Muchas de ellas son usadas como defensa contra otras plantas (alelopatía) o como defensa contra insectos y aun contra grandes herbívoros.
Los árboles y plantas grandes producen sustancias que los hace poco digeribles como son los taninos y las ligninas, mientras que las pequeñas, de vida más corta, se defienden con sustancias tóxicas como los alcaloides.
Esto es sobre todo importante en los trópicos, donde gran parte de las cosechas se pierden consumidas por plagas como insectos u hongos.
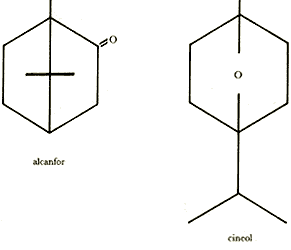
También en las zonas áridas es importante, ya que allí se da la guerra química entre plantas, que consiste en la lucha por la poca agua existente: las plantas bien armadas, como las artemisias y las salvias, despiden por el follaje sustancias volátiles, como el alcanfor o el cineol 1,4, que se adhieren a la tierra impidiendo la germinación de plantas que pueden competir por el agua.
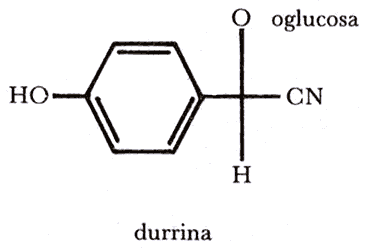
Algunas otras plantas despiden sustancias tóxicas, ya sea por su follaje, cuando están vivas, o como producto de degradación, al descomponerse en el suelo. Estas sustancias que impregnan el suelo evitan la germinación y, en caso de que nazcan otras plantas, retardan su crecimiento, evitando así la competencia por el agua. Éste es el caso del sorgo, cuyo follaje al descomponerse produce el glicósido ciano-genético-durrina, que inhibe la germinación de muchas plantas:
Cuando la paja se ha revuelto en la tierra antes de la siembra, el follaje del arroz se descompone produciendo varios ácidos aromáticos que retardan el crecimiento de las plántulas de arroz en la nueva estación de crecimiento, reduciendo así en forma notable la segunda cosecha.
Más aún, los extractos del suelo donde crece este arroz de pobre rendimiento, así como los extractos de paja en descomposición, inhibieron la formación de raíces en cortes de frijol.
Las sustancias inhibidoras aisladas de los extractos fueron los ácidos p-hidroxi benzoico, p-coumárico, vainíllico y o-hidroxifenil acético, cuyas fórmulas se muestran en seguida:
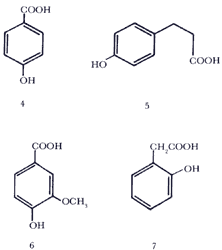
Efectos alelopáticos se han encontrado en artemisias y otras plantas aromáticas, incluyendo árboles como el pirul (Schinus molle).
MENSAJEROS QUÍMICOS EN INSECTOS Y PLANTAS
Existen tres clases principales de mensajeros químicos: alomonas, kairomonas y feromonas
Existen tres clases principales de mensajeros químicos: alomonas, kairomonas y feromonas
Las alomonas son sustancias que los insectos toman de las plantas y que posteriormente usan como arma defensiva; las kairomonas son sustancias químicas que al ser emitidas por un insecto atraen a ciertos parásitos que lo atacarán, y las feromonas son sustancias químicas por medio de las cuales se envían mensajes como atracción sexual, alarma, etcétera.
Un ejemplo de alomona es la sustancia que la larva de la mosca de los pinos (Neodiprion sertifer) toma de los pinos en donde vive. Cuando ésta es atacada, se endereza y escupe una sustancia que contiene repelentes. Si el atacante persiste en su intento, recibe suficiente sustancia que, por su naturaleza viscosa, lo inmoviliza.
Las sustancias que la larva lanza son una mezcla de a y b pinenos con ácidos resínicos, es decir brea disuelta en aguarrás. Es interesante notar que los terpenos a y b pineno, así como los ácidos diterpénicos de la brea, son usados por la planta como defensa contra insectos. En este caso, el insecto se ha adaptado a vivir en presencia de estas armas del árbol, las toma, las hace suyas y las usa contra sus enemigos.
Es interesante el caso del chapulín (Romalia microptera) que se defiende lanzando una sustancia que contiene 2,5-diclorofenol probablemente tomado de los herbicidas que contienen las plantas que comió, los que con muchas posibilidades modificó al detoxificar el ácido 2,4,5-diclorofenoxi o ácido 2,4-D.
Las kairomonas son sustancias que denuncian a los insectos herbívoros ante sus parásitos, a los que atraen. Sobre ellos depositan sus huevecillos para que, cuando nazcan, las larvas se alimenten de ellos.
Las kairomonas probablemente sean producidas por la planta de la que se alimenta el insecto herbívoro, el cual, al comerlas, las concentra en su cuerpo atrayendo a su parásito. De esta manera la planta se defiende de forma indirecta, ya que el insecto que la devora concentra la sustancia que lo delatará.
La estructura de muchas kairomonas es muy sencilla; por ejemplo, la del gusano cogollero (Helianthis zea) es el hidrocarburo tricosano, sustancia que atrae al parásitoTrichograma evanescens. En el gusano que ataca al tubérculo de la papa existe ácido heptanoico.
Los insectos usan varios medios para comunicarse, pero cualquiera que sea la modalidad, el insecto anuncia su presencia no sólo a congéneres, sino a otros insectos que tienen el aparato apropiado para detectarlo. Por ejemplo, las feromonas, cuando son liberadas para atraer al sexo contrario, proclaman territorio y alarman a los de su misma clase. Por tanto, son importantes medios de comunicación entre los de su especie; sin embargo, también son advertidos por otros insectos, por lo que tales sustancias sirven al parásito para localizar a su víctima.
FEROMONAS DE MAMÍFEROS
El que los animales respondan a señales químicas se sabe desde la Antigüedad: los perros entrenados siguen a su presa por el olor.
El que los animales respondan a señales químicas se sabe desde la Antigüedad: los perros entrenados siguen a su presa por el olor.
Las sustancias químicas son a veces características de un individuo que las usa para demarcar su territorio. Más aún, ciertas sustancias le sirven para atraer miembros del sexo opuesto.
El marcar su territorio le ahorra muchas veces el tener que pelear, ya que el territorio marcado será respetado por otros congéneres y habrá pelea sólo cuando el territorio marcado sea invadido.
Las manadas de leones o los grupos de lobos tienen su territorio de grupo. Estos territorios son marcados con frecuencia con orina, con heces, o con diferentes glándulas, tal como lo hace el gigantesco roedor sudamericano, el capibara, con la glándula nasal.
Estas secreciones están compuestas por una gran variedad de sustancias químicas, las cuales sirven para identificar la especie, el sexo y aun a un individuo particular.
Se piensa que la secreción de las glándulas especiales debe estar compuesta por feromonas, pero sólo unas pocas han podido ser probadas como tales. De la misma forma, es probable que la orina, las heces y la saliva también contengan feromonas, pero ha resultado difícil comprobarlo.
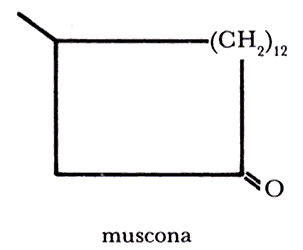
La muscona secretada en la glándula abdominal del venado almizclero macho es una feromona que caracteriza la especie y su sexo, aunque también se excreta la miscapiridina y los esteroides.
El interés en el sexo opuesto es despertado por el olor de ciertos compuestos. Después el animal investiga el estado sexual en que se encuentra, mediante el análisis de la orina en donde se secretarán hormonas sexuales y sus productos de descomposición.
Lo más difícil de entender es cómo distinguen a un individuo entre miles de la misma especie. Al estar marcado un territorio, cada individuo debe saber si es el suyo o es ajeno a partir de señales químicas (olor).
Es bien conocido y divulgado el hecho de que los perros pueden distinguir el olor característico de su amo entre miles de personas con sólo oler una de sus prendas de vestir.
Y así como el perro distingue a una persona entre miles, puede distinguir a otro perro y lo mismo hacen otros mamíferos.
La secreción vaginal en el mono rhesus, así como en la mujer, contiene ácidos grasos, como el ácido acético y el isovaleriánico, que varían cíclicamente con la menstruación. Esta secreción entre los monos tiene la función de atrayente sexual; los machos son atraídos por la hembra en la época en que ésta es fértil.
HORMONAS SEXUALES
El ser humano, al igual que otros seres vivos, produce hormonas que ayudan a regular sus funciones. Entre las diversas hormonas que aquél produce se encuentran las hormonas sexuales. Éstas son sustancias químicas pertenecientes al grupo de los esteroides, pertenecientes al mismo grupo que el de los ácidos biliares y el colesterol.
El ser humano, al igual que otros seres vivos, produce hormonas que ayudan a regular sus funciones. Entre las diversas hormonas que aquél produce se encuentran las hormonas sexuales. Éstas son sustancias químicas pertenecientes al grupo de los esteroides, pertenecientes al mismo grupo que el de los ácidos biliares y el colesterol.
Las hormonas sexuales son producidas y secretadas por los órganos sexuales, bajo el estímulo de sustancias proteicas que llegan, por medio de la corriente sanguínea, desde el lóbulo anterior de la pituitaria en donde estas últimas se producen.
HORMONAS MASCULINAS (ANDRÓGENOS)
Las hormonas masculinas son las responsables del comportamiento y las características masculinas del hombre y otros similares.
Las hormonas masculinas son las responsables del comportamiento y las características masculinas del hombre y otros similares.
Los caracteres sexuales secundarios que en el hombre son, entre otros, el crecimiento de barba y bigote, en el gallo son muy notables y han servido para evaluar sustancias con actividad de hormona masculina.
Cuando un gallo es castrado, su cresta y espolones disminuyen en tamaño hasta casi desaparecer. Si a este gallo se le administra una hormona masculina como testosterona o androsterona, la cresta y espolones vuelven a crecer.
En un método de valoración se inyecta a varios gallos preparados, cantidades cuidadosamente pesadas de sustancias con actividad de hormona masculina (androgénica) y se mide el crecimiento de su cresta. Mientras más activa sea la sustancia, menor cantidad se necesitará para lograr un determinado crecimiento.
HORMONAS FEMENINAS (ESTRÓGENOS)
Las hormonas femeninas son sustancias esteroidales producidas en el ovario. Estas sustancias dan a la mujer sus características formas redondeadas y su falta de vello en el rostro.
Las hormonas femeninas son sustancias esteroidales producidas en el ovario. Estas sustancias dan a la mujer sus características formas redondeadas y su falta de vello en el rostro.
La hormona responsable de estas características en la mujer se llama estradiol y tiene la estructura mostrada en seguida:
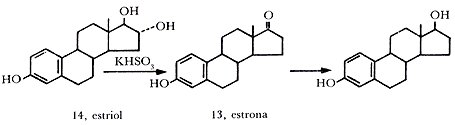
Por muchos años se creyó que la hormona femenina era la estrona, una sustancia encontrada en la orina femenina. Sin embargo, esta sustancia, que ciertamente tiene actividad hormonal, es en realidad un producto de descomposición de la verdadera hormona femenina, que es el estradiol.
El estradiol se obtuvo por primera vez mediante reducción de la estrona aislada de la orina y mostró ser una hormona nueve veces más potente que la estrona.
Su aislamiento se logró en 1935 por Doisy y su grupo. De 1.5 kg de ovarios de puerca se aislaron tan sólo 12 mg de estradiol en forma de su di-a-naftoato.
Evidentemente la obtención de estradiol era inadecuada y por muchos años se siguió aislando la estrona de orina tanto de yegua como de mujer.
La estrona era por lo tanto aplicada directamente, pero parte de ella era transformada, por medio de una reducción, en la auténtica y muy potente hormona femenina, el estradiol.
Junto con la estrona se aislaba de la orina otro producto, el triol, llamado estriol (véanse fórmulas anteriores). Esta sustancia, aunque menos potente que la estrona cuando es inyectada, es activa por vía oral debido a que posee un grupo OH de más, lo que la hace más soluble en agua (HOH).
El estradiol, que como acabamos de mencionar se empezó a producir por reducción de la estrona, ahora se produce por síntesis total.
ESTRÓGENOS SINTÉTICOS (NO NATURALES)
Existen dos sustancias sintéticas que, aunque no poseen estructura de esteroide, tienen fuerte actividad hormonal (estrogénica). Estas son las drogas llamadas estilbestrol y hexestrol.
Estas sustancias, aunque poseen una potente actividad de hormona femenina, no son aplicables a personas dada su alta toxicidad. Sin embargo, encuentran su campo de aplicación en la rama veterinaria.
LA PROGESTERONA (ANTICONCEPTIVOS)
Desde principios del siglo (1911), L. Loeb demostró que el cuerpo amarillo del ovario inhibía la ovulación. L. Haberland, en 1921, al trasplantar ovarios de animales preñados a otros animales observó en estos últimos una esterilidad temporal. Los hechos anteriores indicaban que en el ovario y especialmente en el llamado cuerpo amarillo que se desarrolla en el ovario, después de la fecundación, existía una sustancia que produce esterilidad al evitar la ovulación.
Desde principios del siglo (1911), L. Loeb demostró que el cuerpo amarillo del ovario inhibía la ovulación. L. Haberland, en 1921, al trasplantar ovarios de animales preñados a otros animales observó en estos últimos una esterilidad temporal. Los hechos anteriores indicaban que en el ovario y especialmente en el llamado cuerpo amarillo que se desarrolla en el ovario, después de la fecundación, existía una sustancia que produce esterilidad al evitar la ovulación.
La sustancia producida por el cuerpo amarillo y que evita que haya ovulación mientras dura el embarazo fue aislada en 1931 y se llamó progesterona
ANTICONCEPTIVOS
La acción de la progesterona aislada en 1934 es muy específica. Ningún otro producto natural la posee y, como era muy escasa, se intentó su síntesis. En 1935 el colesterol pudo ser degradado oxidativamente a dehidro espiandrosterona (DHA).
La acción de la progesterona aislada en 1934 es muy específica. Ningún otro producto natural la posee y, como era muy escasa, se intentó su síntesis. En 1935 el colesterol pudo ser degradado oxidativamente a dehidro espiandrosterona (DHA).
Contando con
DHA como materia prima, Imhoffen intentó transformarlo en progesterona por adición de los dos carbones faltantes mediante aceliluro de potasio. El producto obtenido no fue progesterona, pero, sin embargo, la esterona, que fue la que se produjo, tuvo actividad progestacional, y aunque ésta posee tan sólo una tercera parte de la actividad de la progesterona cuando es inyectada, es más activa que ella por vía oral.
Este descubrimiento inició la era de los anticonceptivos artificiales, la era de la píldora anticonceptiva. Imhoffen y Hohlweg aplicaron la reacción de etinilación a la hormona femenina estrona y obtuvieron etinilestradiol, el primero y uno de los más importantes estrógenos sintéticos activos por vía oral.
Por lo general, los productos naturales son más activos en su forma original que cuando sufren una modificación; sin embargo, la 19-nor-progesterona, preparada por Ehrenstein en 1944, mostró ser más activa que la progesterona. Este hecho inspiró a A. Birch y Mikherjii para la preparación de 19-nortestosterona, para lo cual redujeron a la estrona en forma de éter metílico con litio disuelto en amoniaco líquido, método introducido por el propio Birch para reducir anillos aromáticos en la misma reacción. Se redujo así la cetona del C-17, enseguida se hidrolizó el éter y finalmente se conjugó la doble ligadura para dar la 19-nortestosterona.
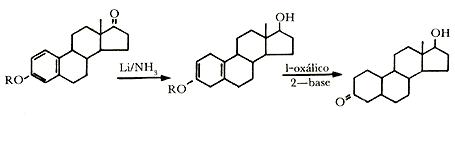
19 - nortestosterona
Es de hacer notar que la testosterona, que es la hormona masculina, cambia su actividad a tipo femenino al quitársele un átomo de carbono (CH3). Si a la sustancia anterior se le adiciona un par de átomos de carbono, se tendrá la 17-a-etinil-19-nortestosterona, que posee gran actividad progestacional, es decir es un potente anticonceptivo.
Es de hacer notar que la testosterona, que es la hormona masculina, cambia su actividad a tipo femenino al quitársele un átomo de carbono (CH3). Si a la sustancia anterior se le adiciona un par de átomos de carbono, se tendrá la 17-a-etinil-19-nortestosterona, que posee gran actividad progestacional, es decir es un potente anticonceptivo.
MI OPINIÓN.
En este capítulo son mencionadas las sustancias químicas que producen nuestro cuerpo que son las hormonas y que no solo los humanos son los únicos que producimos hormonas ya que las plantas también lo hacen y desde que germinan, lo interesante que con el conocimiento que tenemos acerca de las sustancias químicas de nuestro cuerpo se han logrado hacer medicamentos como los esteroides, pero lamentable mente el uso de estas sustancias han sido utilizadas para el crecimiento muscular pero tiene consecuencias devastadoras para quien las consume.
IX.GUERRAS QUÍMICAS, ACCIDENTES QUÍMICOS
GUERRA QUÍMICA
A
A
NTES de que el hombre apareciera sobre la Tierra ya existía la guerra. Los vegetales luchaban entre sí por la luz y por el agua y sus armas eran sustancias químicas que inhiben la germinación y el crecimiento del rival. La lucha contra insectos devoradores ha sido constante durante millones de años. Las plantas mal armadas sucumben y son sustituidas por las que, al evolucionar, han elaborado nuevas y más eficaces sustancias que las defienden. Los insectos también responden, adaptándose hasta tolerar las nuevas sustancias; muchos perecen y algunas especies se extinguen, pero otras llegan a un acuerdo y logran lo que se llama simbiosis, brindándose ayuda mutua, como el caso de laYucca y la Tegeticula mexicana. En esta vida en simbiosis, la Yucca proporciona alimento y materia prima hormonal a la mariposa nocturna. Ésta, en cambio, se encarga de polinizar las flores de la planta asegurándole así su fructificación y reproducción.
De la misma forma, las abejas toman néctar y polen de las flores, pero a cambio ayudan a la fructificación y por consiguiente a la reproducción de la planta al polinizar sus flores.
La Acacia cornigera, que tiene espinas huecas, es hogar de gran cantidad de hormigas del género Pseudomyrmex, que no sólo viven en la planta, sino que se alimentan del líquido azucarado que ésta secreta por medio de sus grandes glándulas foliares. A cambio de casa y comida, las hormigas defienden a la planta contra otros depredadores.
GUERRA ENTRE INSECTOS Y DE INSECTOS CONTRA ANIMALES MAYORES
Muchos insectos poseen aguijones conectados a glándulas productoras de sustancias tóxicas con los que se defienden de los intrusos. Las avispas y las abejas son insectos bien conocidos por inyectar sustancias que causan dolor y alergias. El hombre conoce bien estas cualidades, pues muchas veces por perturbar la tranquilidad del enjambre ha sido inyectado con dopamina o histamina, sustancias entre otras que son responsables del dolor, comezón e hinchazón de la parte atacada.
Muchos insectos poseen aguijones conectados a glándulas productoras de sustancias tóxicas con los que se defienden de los intrusos. Las avispas y las abejas son insectos bien conocidos por inyectar sustancias que causan dolor y alergias. El hombre conoce bien estas cualidades, pues muchas veces por perturbar la tranquilidad del enjambre ha sido inyectado con dopamina o histamina, sustancias entre otras que son responsables del dolor, comezón e hinchazón de la parte atacada.
Las hormigas, por su parte, incluyen entre sus armas, además del ácido fórmico u ácido de hormiga, los alcaloides monomorina I, II y III, que, además de sustancias de defensa, le sirven para marcar sus caminos.
Algunos insectos escupen sustancias tóxicas sobre el enemigo, como lo hace el escarabajo bombardero.
Otras armas químicas usadas por las hormigas para su defensa son las que se muestran a continuación:
La gente que es alérgica se puede sentir muy mal por un solo piquete de abeja, de manera que, por ejemplo, la abeja africana puede llegar hasta causar la muerte a estas personas sensibles.
Otros insectos producen repelentes para su defensa: algunos gusanos malolientes producen aldehído butírico (CH3CH2CH2CHO).
Los escarabajos, como las catarinas y las luciérnagas, producen alcaloides tetracíclicos que tienen muy mal olor.
El insecto bombardero del que hablamos anteriormente escupe con violencia una mezcla de quinonas, como benzonona y toluquinona.

Los mamíferos también poseen armas químicas. Es bien conocido por todos el arma tan poderosa que posee el zorrillo. Cuando este animal es atacado por un depredador, ya sea el hombre u otro animal, utiliza su arma química: lanza con fuerza un líquido irritante con un olor desagradable que persiste por horas y aun por días en los objetos que tocó. Entre los componentes del olor a zorrillo se encuentra el butil mercaptano.
Muchos insectos poseen glándulas en donde se acumula el veneno, teniendo cada uno una manera propia de inyectarlo. Las arañas, por ejemplo, tienen sus glándulas venenosas en el cefalotórax y le inyectan veneno a su presa.
Los escorpiones inyectan una sustancia venenosa que contiene sustancias de bajo peso molecular. Entre ellas ya se han identificado la histamina así como algunos compuestos indólicos.
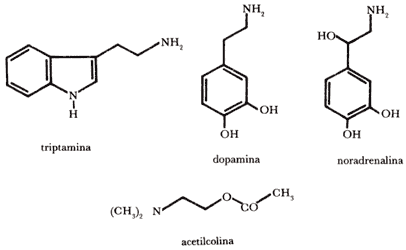
EL HOMBRE USA LA QUÍMICA PARA LA GUERRA
Posiblemente la primera reacción química que el hombre aprovechó para destruir a su enemigo fue el fuego. La misma reacción de oxidación que logró dominar para tener luz y calor, para cocinar alimentos y fabricar utensilios, en fin, para hacer su vida más placentera, fue usada para dar muerte a sus congéneres al quemar sus habitaciones y cosechas.
Posiblemente la primera reacción química que el hombre aprovechó para destruir a su enemigo fue el fuego. La misma reacción de oxidación que logró dominar para tener luz y calor, para cocinar alimentos y fabricar utensilios, en fin, para hacer su vida más placentera, fue usada para dar muerte a sus congéneres al quemar sus habitaciones y cosechas.
Al pasar el tiempo el hombre inventa un explosivo, la mezcla de salitre, azufre y carbón, que es usada en un principio para hacer cohetes que alegraron fiestas y celebraciones. Este descubrimiento, atribuido a los chinos, fue utilizado posteriormente por el hombre para disparar proyectiles y así poder cazar animales para su sustento.
Pero el hombre, siempre agresivo, terminó por emplear el poder explosivo de la pólvora para hacer armas guerreras y así enfrentarse a su enemigo.
Más tarde se fueron descubriendo explosivos más poderosos. Varios productos nitrados, por su alto contenido de oxígeno, son buenos explosivos. Así, la nitración de la
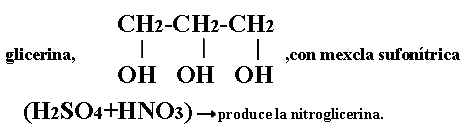
Esta sustancia es sumamente peligrosa pues explota con mucha facilidad, por lo que debe tenerse mucho cuidado a la hora de su fabricación. Con todo, a pesar de su peligrosidad el hombre la fabrica y la usa para la guerra debido a la gran cantidad de gases que produce al explotar, pues 1 kg de nitroglicerina produce 782 litros de gases, además de una gran cantidad de calor: 1 kg produce 1 6l6 K cal.
En la segunda Guerra Mundial se usó otra sustancia orgánica nitrada, el trinitrotolueno o
TNT, obtenida por tratamiento del tolueno con mezcla sulfonítrica.
El
TNT es también un potente explosivo, pero de manejo mucho más seguro que la nitroglicerina. 1 kg de TNT produce 730 litros de gases y 1 080 K cal. Es decir, un volumen de ±1 litro se expande a 730 litros.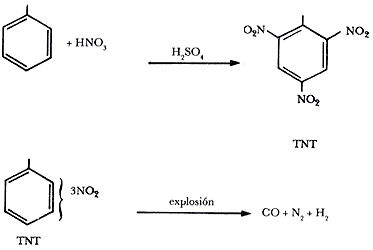
Pero el hombre no se ha conformado con fabricar armas basadas en en reacciones químicas, sino que ha manipulado el átomo para crear la bomba atómica
LA BOMBA DE HIROSHIMA
La bomba lanzada sobre Hiroshima fue una bola de uranio 235 no mayor de 8 cm de diámetro y de más o menos 5 kg. Pero como la fisión del uranio tiene un poder explosivo aproximadamente 10 millones de veces mayor que el
TNT, la bomba debió equivaler a 20,000 tons de TNT.
USO DE SUSTANCIAS TÓXICAS EN LA GUERRA
Las sustancias de alta toxicidad fueron utilizadas como armas químicas en la primera Guerra Mundial. Los alemanes lanzaron, en abril de 1915, una nube de cloro sobre los soldados franceses quienes, al no estar protegidos, tuvieron que retirarse varios kilómetros. Pocos días después los alemanes repitieron el ataque contra las tropas canadienses con los mismos resultados.
Las sustancias de alta toxicidad fueron utilizadas como armas químicas en la primera Guerra Mundial. Los alemanes lanzaron, en abril de 1915, una nube de cloro sobre los soldados franceses quienes, al no estar protegidos, tuvieron que retirarse varios kilómetros. Pocos días después los alemanes repitieron el ataque contra las tropas canadienses con los mismos resultados.
Las fuerzas aliadas pronto fueron protegidas con máscaras que, aunque rudimentarias, evitaron un desastre que parecía inminente.
Un poco más tarde los alemanes continuaron con la guerra química lanzando granadas con gases lacrimógenos. Sin embargo, la más poderosa arma química usada en la primera Guerra Mundial fue el gas mostaza. Empleado por primera vez en julio de 1917 por los alemanes en la batalla de Ypres, Bélgica, causó terribles daños a las tropas francesas.
El gas mostaza se llamó de esta manera por tener un olor parecido al de la mostaza. No es realmente un gas, sino un líquido irritante que hierve a alta temperatura, el cual debido a su baja tensión superficial produce vapores, los que, por su alta toxicidad, basta con que exista una muy baja concentración en el aire para causar molestias a la gente o incluso causarles la muerte.
El gas mostaza se prepara haciendo reaccionar etileno con cloruro de azufre como se muestra en la siguiente reacción:
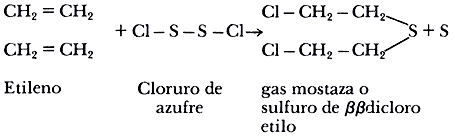
Una vez repuestos los ejércitos aliados de la sorpresa que representó la guerra química, se protegieron adecuadamente, y sus científicos comenzaron, a su vez, a idear y preparar sus propias armas químicas.
Las sustancias empleadas por ambos bandos conforma una larga lista, entre la que se cuenta a los gases lacrimógenos, como cloro y bromoacetona,
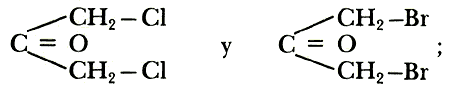
diversas sustancias como cloro, sulfato de dimetilo, etil carbazol, fosgeno, etc., y venenos de la sangre, como el ácido cianhídrico (HCN). Este último es el gas que se usaba en la cámara de gases contra los condenados a muerte.
Para la segunda Guerra Mundial se eliminaron la mayor parte de las sustancias tóxicas utilizadas en la primera Guerra y sólo quedaron unas cuantas como el gas mostaza, el fosgeno, y el ácido cianhídrico para usos especiales.
GASES NEUROTÓXICOS
Los alemanes desarrollaron a finales de la segunda Guerra Mundial los gases neurotóxicos sarina o GB y tabun.
GASES NEUROTÓXICOS
Los alemanes desarrollaron a finales de la segunda Guerra Mundial los gases neurotóxicos sarina o GB y tabun.
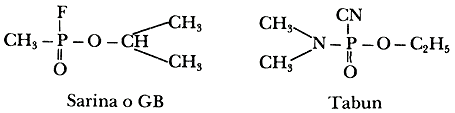
Estos gases son más letales que las armas químicas usadas en la primera Guerra Mundial. Son inodoros, por lo que es muy difícil detectarlos antes de que hayan hecho daño mortal.
La ventaja de las armas químicas es que son baratas y no requieren de una tecnología muy avanzada, de manera que prácticamente cualquier ejército puede ser dotado de ellas, sin contar de que son muy fáciles de arrojar contra el enemigo.
ESPIONAJE QUÍMICO. EL POLVO DE LOS ESPÍAS
El aldehído aromático 5(4-nitrofenilo)-2,4-pentadien -1-al ha sido usado para marcar el camino seguido diariamente
El aldehído aromático 5(4-nitrofenilo)-2,4-pentadien -1-al ha sido usado para marcar el camino seguido diariamente
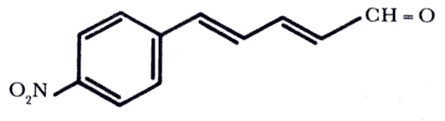
por personas sometidas a investigación. El aldehído, que es un polvo amarillo, se coloca sobre objetos que normalmente se tocan, tales como el volante del automóvil, el pasamanos de la escalera y la cerradura de la puerta. La sustancia, colocada en pequeñas cantidades, se adhiere a la mano y luego puede ser detectada en los objetos que el individuo tocó posteriormente. De esta manera se puede seguir el trayecto de la persona investigada.
Para detectar el aldehído se desarrolló un procedimiento analítico que consiste en pasar un algodón humedecido con alcohol sobre el objeto tocado. Se pone el algodón en un tubo de ensayo que contenga 0.5 ml de metanol además de el mismo volumen de naftoresorcinol al 1% en metanol; al agregar 0.5 ml de ac. clorhídrico concentrado se desarrolla un color que va del rosado al violeta.
El color también se puede desarrollar directamente sobre el algodón con que se limpió el objeto tocado por la persona investigada. Si a este algodón se le añade el naftoresorcinol y una gota de ácido clorhídrico y se tiñe de rosa o de violeta, indicará la presencia del polvo de aldehído.
El método es tan sensible, que se ha podido detectar la presencia de 150 nanogramos de polvo de los espías distribuidos en 100 cm2.
Éste no se elimina de las manos por un simple lavado con agua, pero si se lavan cuidadosamente con agua y jabón, la prueba es negativa, indicando su total eliminación.
MI OPINIÓN.
Este capítulo fue el que más me intereso porque muestra como el hombre utiliza su inteligencia para el mal, el capítulos anteriores hemos visto que los descubrimientos fueron para su beneficio pero de iguálenmela a utilizado sustancias químicas para la destrucción y una vez más se nos muestra porque la necesidad es la madre de los inventos porque es como crea sustancias explosivas como el TNT y como da origen a la arma más destructora de todas la bomba atómica y en mi opinión personal, me parece que el hombre utiliza su inteligencia para el bien pero en ciertas situaciones para la devastación.
BIBLIOGRAFIA.
Titulo: Química, Universo, Tierra y vida.
Autor: Alfonso Romo de Vivar.
Editorial: SEP.
Año: 1995
P.P: 160
No hay comentarios:
Publicar un comentario